
| A.56(3x+y)g | B.56(3x-y) g | C.28(3x+y)g | D.28(3x-y)g |
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源:不详 题型:实验题
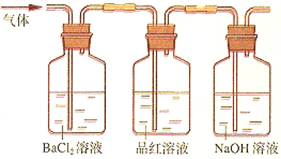
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
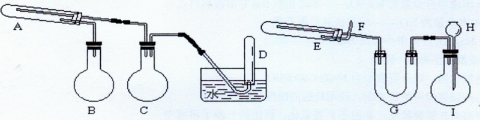
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验: 称量、__▲_____、转移、洗涤并转移、____▲____摇匀。
称量、__▲_____、转移、洗涤并转移、____▲____摇匀。 ”“偏高”“不变”)
”“偏高”“不变”) 质量;计算结晶水含量。请纠正实验过程中的两处错误;___▲_____;_____▲____。
质量;计算结晶水含量。请纠正实验过程中的两处错误;___▲_____;_____▲____。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1 mo/L | B.1 mo/L | C.0.08 mo/L | D.0.8 mo/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
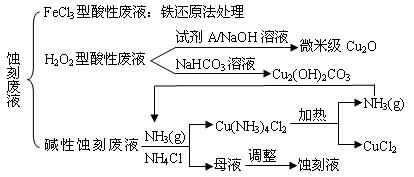
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
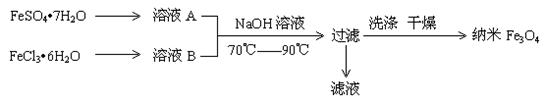
 O 和 FeCl3·6H2O的物质的量之比最好应为 ,在此条件下,检验铁元素是否沉淀完全的实验操作是 。
O 和 FeCl3·6H2O的物质的量之比最好应为 ,在此条件下,检验铁元素是否沉淀完全的实验操作是 。| A.纳米Fe3O4磁硫体分散系属于溶液。 |
B.纳米Fe3O4磁硫体可 以通过渗析法得到提纯。 以通过渗析法得到提纯。 |
| C.当一束可见光通过该磁硫体时会出现光亮的通路。 |
| D.纳米Fe3O4磁硫体比较稳定。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com