
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积的关系如图,下列说法正确的是
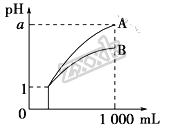
①若a<4,则A、B都是弱酸 且电离平衡常数K(A)<K(B)
②稀释后,B酸溶液的酸性比A酸溶液强
③若a=4,则A是强酸,B是弱酸
④稀释前A、B两种酸溶液的物质的量浓度一定相等
A. ①④ B. ②③ C. ①③ D. ②④
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是

A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. 由状态B到状态A,可以用加热的方法
D. A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4可表示为FeOFe2O3 , 是一种性能优良的新型磁性材料.水热法制备Fe3O4纳米级颗粒的反应为3Fe2++2S2O32﹣+O2+xOH﹣=Fe3O4+S4O62﹣+yH2O.下列说法中,不正确的是( )
A.每生成1mol Fe3O4 , 反应转移的电子总数为4mol
B.该反应中,氧化剂与还原剂物质的量之比为1:5
C.3mol Fe2+被氧化时,消耗O2标准状况下的体积约为22.4L
D.x=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,下列有关该反应的说法正确的是
A. H2O是还原剂 B. Na2O2被还原 C. H2O失电子 D. O2 是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,将537.6L氯化氢气体溶于水配成2L溶液,试计算:
①该盐酸的物质的量浓度是________。
②8.7gMnO2与100mL该盐酸反应,求生成的气体在标准状况下的体积________升。
③向反应后的溶液中加入足量的AgNO3溶液,可生成沉淀的物质的量是________。
(2)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________L,NO2的体积为________L。(结果保留一位小数)
②待产生的气体全部释放后,向溶液加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol/L。
③欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,取0.1mol·L-1HY溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法正确的是
A. 混合溶液中由水电离出的c(OH-)=1×10-9mol/L
B. 混合溶液中离子浓度由大到小的顺序为c(Y-)﹥c(Na+)﹥c(OH-)﹥c(H+)
C. 混合溶液中c(OH-)-c(HY)= c(H+)=1×10-9mol/L
D. 混合溶液中c(Na+)=c(Y-)+c(HY)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式表达正确的是(![]() 的绝对值均正确)
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸,其K1=5.4×10-2,K2=5.4×10-5,已知碳酸的K1=4.4×10-7,K2=4.7×10-11,
草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9,试回答下列问题:
(1)0.1mol/LNa2CO3溶液的pH_________0.1mol/LNa2C2O4溶液的pH(选填“大于”、“小于”或“等于”)。
(2)下列化学方程式正确的是_______(填选项序号)
A. H2C2O4+CO32-=HCO3-+HC2O4- B.HC2O4-+CO32-=HCO3-+C2O42-
C.H2O+CO2+C2O42-=HC2O4-+HCO3- D.C2O42-+CO2+H2O=H2C2O4+CO32-
(3)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应)。 实验步骤:准确以1g样品Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL.
(已知:5H2C2O4+2KMnO4+3H2SO4===10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在_________滴定管中。(填“酸式”或“碱式”)
②滴定至终点时的实验现象是:__________________________。
③计算样品中Na2C2O4的纯度是_______________________。
(4)草酸钙结石是五种肾结石里最为常见的一种.患草酸钙结石的病人多饮白开水有利于结石的消融.请用化学用语和简要的文字说明其原因:______.
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20℃,1大气压下,将三个分别盛氨气,氯化氢,二氧化氮的等容积烧瓶分别倒置于盛水的水槽中,当水进入烧瓶中,并使气体充分溶解后,假定烧瓶中溶液无损失,所得溶液的物质的量浓度之比为
A. 5 : 5 : 4 B. 1 : 2 : 3 C. 1 : 1 : 1 D. 1 : 1 : 2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com