
| 实验操作和现象 | 实验结论 | |
| A | 检验某溶液中是否含有SO42-时,向溶液中滴加用盐 酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 检验输送氯气的管道是否发生泄漏时,用一根玻璃棒蘸取浓氨水,然后靠近管道 | 有白色烟雾产生时说明管道发生泄漏 |
| C | 检验FeCl3溶液中是否含有Fe2+时,向溶液中滴加 酸性KMnO4溶液,溶液变为无色 | 该溶液中一定含有Fe2+ |
| D | 向2mL0.1mol•L-1 硝酸银溶液中加入几滴0.1mol•L-1NaCl溶液,出现白色沉淀,再加入几滴0.1mol•L-1Na2S溶液,有黑色沉淀生成 | 该现象说明相同温度下Ksp(Ag2S)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.向溶液中滴加用盐 酸酸化的BaCl2溶液,可能生成AgCl沉淀;
B.氯气和浓氨水发生氧化反应生成氮气和氯化铵;
C.酸性条件下,高锰酸钾可氧化亚铁离子,溶液呈黄色;
D.硝酸银过量,不存在沉淀的转化.
解答 解:A.向溶液中滴加用盐酸酸化的BaCl2溶液,可能生成AgCl沉淀,应先加入盐酸酸化,如无现象,再加入氯化钡,故A错误;
B.氯气和浓氨水发生氧化反应生成氮气和氯化铵,如氯气泄漏,可观察到白烟生成,故B正确;
C.酸性条件下,高锰酸钾可氧化氯离子,生成铁离子,溶液呈黄色,不是无色,故C错误;
D.硝酸银过量,不存在沉淀的转化,不能证明溶度积大小,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,侧重考查学生的分析能力和实验能力,把握物质的性质及发生的化学反应、反应原理为解答的关键,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气中含有的氮氧化物是汽油不完全燃烧造成的 | |
| B. | 光导纤维、碳纤维、聚酯纤维都是新型无机非金属材料 | |
| C. | PM2.5(颗粒直径接近2.5×10-6m)分散在空气中能够产生丁达尔效应 | |
| D. | 以液化石油气代替燃油可减少大气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Y>Z | |
| B. | 最高价氧化物对应水化物的酸性:Y<Z | |
| C. | 工业上制备W单质的方法为热还原法 | |
| D. | X分别与Y、Z形成的简单化合物所含化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、Al(OH)3 | B. | AgNO3、NH4Cl | C. | MgSO4、BaCl2 | D. | CuCl2、Al(NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某同学的体检报告单显示其血液中葡萄糖含量为4.94mmol/L,mmol/L是物质的量的单位 | |
| B. | 石油是复杂的混合物,通过分馏可以获得汽油、煤油等,通过催化重整可以获得乙烯、丙烯等 | |
| C. | 自然界中的方铅矿(PbS),遇上CuSO4溶液会慢慢变成铜蓝(CuS)说明Ksp(PbS)>Ksp(CuS) | |
| D. | 水玻璃是制备木材防火剂的原料,其主要成分是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
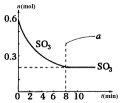 在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )
在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )| A. | 0~8min内v(SO3)=0.025mol/(L•min) | |
| B. | 8min时,v逆(SO2)=2v正 (O2) | |
| C. | 8min时,容器内压强保持不变 | |
| D. | 若8min时将容器压缩为1L,n(SO3)的变化如图中a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯和水 | B. | 硝酸钾和氯化钠 | C. | 乙酸乙酯和乙酸 | D. | 食盐水和泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com