
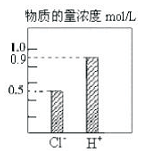
 l00mL稀H2S04和稀HC1的混合溶液中,部分离子的浓度关系如图所示,
l00mL稀H2S04和稀HC1的混合溶液中,部分离子的浓度关系如图所示,分析 (1)根据氯离子守恒判断HCl的物质的量,然后根据氢离子的物质的量计算出硫酸的物质的量,最后根据c=$\frac{n}{V}$计算出原混合液中H2SO4的物质的量浓度;
(2)先根据n=$\frac{m}{M}$计算出8.55g Ba(OH)2的物质的量,然后可知氢氧根离子的物质的量,再根据中和反应实质计算出充分反应后所得溶液中氢氧根离子的物质的量.
解答 解:(1)根据图示可知,混合液中氯离子的物质的量为0.5mol,根据质量守恒可知混合液中含有HCl的物质的量为0.5mol,既混合液中HCl电离出的氢离子为0.5mol,则硫酸电离出的氢离子的物质的量为:0.9mol-0.5mol=0.4mol,混合液中含有硫酸的物质的量为:n(H2SO4)=0.4mol×$\frac{1}{2}$=0.2mol,原混合液中H2SO4的物质的量浓度为:c(H2SO4)=$\frac{0.2mol}{0.1L}$=0.2mol/L,
答:原混合液中H2SO4的物质的量浓度为0.2mol/L;
(2)8.55g Ba(OH)2的物质的量:n(Ba(OH)2)=$\frac{8.55g}{171g/mol}$=0.05mol,含有氢氧根离子的物质的量为:0.05mol×2=0.1mol,反应后溶液中氢氧根离子的物质的量为:0.1mol-0.9mol=0.1mol,
答:充分反应后,所得溶液中OH-的物质的量为0.01mol.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主食 | 米饭、馒头 |
| 副食 | 烧鸡块、咸鸭蛋、红烧肉、花生米 |
| 饮料 | 牛奶 |
| 你的补充 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol•L-1 的 H2SO4 溶液 pH=1 | |
| B. | 0.001 mol•L-1 的 NaOH 溶液 pH=ll | |
| C. | 0.005 mol•L-1的H2SO4溶液与0.01 mol•L-1的NaOH溶液等体积混合,混合后溶液pH为5,溶液显酸性 | |
| D. | 完全中和pH=3的H2SO4溶液50 mL,需要PH=11的NaOH溶液50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铜溶液与锌粒反应:Cu2++Zn=Zn2++Cu | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LNO与1.12L O2混合后的分子数小于0.1NA | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| D. | 1molFe与1molCl2充分反应,转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com