
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(杂质中不含铁元素,且杂质不与H2、H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
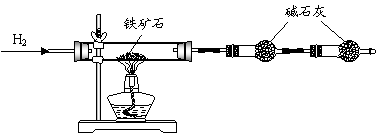 Ⅰ.铁矿石中含氧量的测定
Ⅰ.铁矿石中含氧量的测定
|
实验结果:将5.0g铁矿石放入硬质玻璃管中完全反应, 测得装置B增重1.35 g。
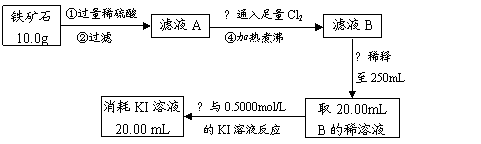 Ⅱ.铁矿石中含铁量的测定
Ⅱ.铁矿石中含铁量的测定
Ⅲ.问题讨论与解决:
(1)如要验证滤液A中铁元素的存在形式,可另取两份滤液A分别进行实验,实验方法、现象与结论如下表。请将其补充完整。
可供选择的试剂有:酸性KMnO4溶液、NaOH溶液、KSCN溶液、氯水
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液A中加入 ▲ | ▲ | 滤液A中有Fe3+ |
| 步骤2:在滤液A中加入 ▲ | ▲ | 滤液A中有Fe2+ |
(2)步骤④中煮沸的作用是: ▲ ;
(3)步骤③中反应的离子方程式为: ▲ ;
(4)请通过实验Ⅰ、Ⅱ计算出该铁矿石中铁的氧化物的化学式。(写出计算过程)
 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
下列物质的应用不涉及氧化还原反应的是( )
A.用稀硝酸洗去附在试管内壁的银镜
B.用热的纯碱溶液清洗油污
C.用新制的氢氧化铜悬浊液与病人的尿液混合加热,来检验病人是否患糖尿病
D.在铁质镀件上镀铜
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中既属于氧化还原反应又属于放热反应的是 ( )
A 氢氧化钾与硫酸的反应 B 锌与盐酸反应放出氢气
C 镁条在空气中燃烧 D Ba(OH)2•8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与科学、技术、社会、环境、生活等密切相关。下列有关说法中错误的是
A.液氨可用作制冷剂
B.小苏打用于治疗胃酸过多
C.明矾可用于自来水的杀菌消毒
D.硅酸钠用于制备硅胶和木材防火剂的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应3Cl2+6NaOH 5NaCl+NaClO3+3H2O,以下叙述正确的
5NaCl+NaClO3+3H2O,以下叙述正确的 是
是
A.Cl2是氧化剂,NaOH是还原剂
B.当有6.72L Cl2反应时,转移电子物质的量为0.5mol
C.氧化剂得电子总数与还原剂失电子总数之比为1∶1
D.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式(Q1、Q2均为正值):
C(s)+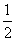 O2(g) ===CO(g) ΔH=-Q1 kJ·mol-1,C(s)+O2(g) ===CO2(g) ΔH=-Q2 kJ·mol-1,
O2(g) ===CO(g) ΔH=-Q1 kJ·mol-1,C(s)+O2(g) ===CO2(g) ΔH=-Q2 kJ·mol-1,
有关上述反应的叙述错误的是
A.Q1<Q2 B.生成物总能量均高于反应物总能量
C.由1 mol C反应生成1 mol CO气体时放出Q1 kJ的热量
D.1 mol CO2气体具有的能量大于1 mol干冰具有的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某可逆反应:mA(g)+nB(g)  pC(g) △H=Q kJ·mol-1 ,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是
pC(g) △H=Q kJ·mol-1 ,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是
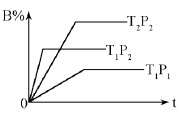
A.T2 >T1 P1 > P2 m+n > p Δ Η<0
B.T1 >T2 P1 < P2 m+n < p Δ Η>0
C.T1 <T2 P1 < P2 m+n < p Δ Η<0
D.T1 >T2 P1 < P2 m+n > p Δ Η>0
查看答案和解析>>
科目:高中化学 来源: 题型:
对于恒容密闭容器中发生的可逆反应N2(g)+3H2(g)  2NH3(g) ΔH<0,能说明反应达到化学平衡状态的是( )
2NH3(g) ΔH<0,能说明反应达到化学平衡状态的是( )
A.断开1个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.N2、H2、NH3分子数之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,请参照①~⑥在表中的位置,用化学用语回答下列问题:
| I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ |
(1) ⑥有两种同位素,其中一种原子核内有18个中子,其原子符号为_______;
(2)②与④可以形成一种温室气体,其电子式为_______;
(3) ③和⑤的氢化物沸点 __________(填分子式)高,原因是______________;
(4)②和⑥按原子个数比为1:4形成的化合物为_______分子(填极性或非极性),含有_______键(填极性或非极性)
(5) ②形成的单质可以是不同类型的晶体,它们可能是____________(填字母)
A原子晶体 B分子晶体 C金属晶体 D离子晶体 E混合型晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com