
【题目】在含少量Mg粉的试管中滴入稀盐酸,产生大量气泡,且试管壁发热.该反应为( )
A. 化合反应B. 复分解反应C. 吸热反应D. 放热反应
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设: 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验: 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN试剂。
(1)若假设1成立,则实验现象是_______________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?__________简述你的理由(不需写出反应的方程式)____________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是__________,写出发生反应的离子方程式______、__________、______________。
探究延伸:
(4)如果经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。某实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BeCl2熔点较低,易升华,溶于醇和醚,其与AlCl3化学性质相似。由此可推断BeCl2的化学键是_______(填“离子键”或“共价键”),其在固态时属于______(填“原子”、“分子”或“离子”)晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置进行浓硫酸和木炭反应的实验,并检验有CO2和SO2两种气体生成。

回答下列问题:
(1)仪器a的名称为_________,A装置中反生反应的化学方程式为___________________________________________。
(2)虚线框内有一处错误,请指出______________________,
装置B的作用是___________________________________________。
(3)装置C中酸性KMnO4溶液用于除去SO2,其目的是________。(填序号)
甲:防止SO2干扰CO2的检验 乙:吸收CO2气体 丙:检验SO2
(4)装置E的现象是_______________________________,E中发生反应的离子方程式为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取Fe(OH)2并使之能久存,可采取的操作有:①加入一些植物油;②溶解FeSO4配成溶液;③把蒸馏水加热煮沸,并密封冷却;④加入少量铁屑;⑤向FeSO4溶液中滴加足量氨水;⑥把盛有氨水的胶头滴管伸入FeSO4溶液中后再挤出氨水。进行操作的正确顺序是
A.③②⑤④B.③②④①⑥C.③②④⑥D.②④①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.氯气是黄绿色、有刺激性气味、有毒的气体
B.三氧化二铝是两性氧化物
C.晶体硅用来制作光导纤维
D.焰色反应是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学电化学知识,回答有关问题。
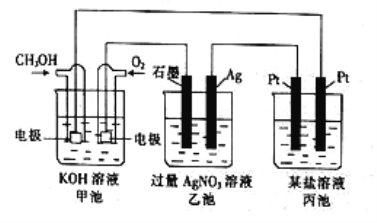
(1)图中甲池是____(填“原电池”或“电解池”)装置,其中OH-移向___(填“正”或“负”)极。
(2)通入CH3OH一端的电极反应式为_____________________。
(3)反应一段时间后,甲池中消耗560mL(标准状况)O2,此时乙池溶液的pH=______(设此时乙池中溶液的体积为100mL)。
(4)当乙池中Ag电极的质量增加5.4g时,丙池中某电极析出1.6g某金属,则丙池中的某盐可能是__________(填字母)。
A.MgSO4 B.CuCl2 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,我国某物理研究所取得重大科技成果,研制出由18O所构成的单质气体。18O是一种稳定的同位素,称为重氧。下列有关说法不正确的是
A. 1.8 g 18O2的物质的量是0.05 mol
B. 0.1 mol H218O中所含的中子数约为6.02×1023
C. 0.2 mol 18O2的体积约为4.48 L
D. 18O2的摩尔质量为36 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石、SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)一定条件下,Na与CCl4可制备金刚石,反应结束冷却至室温后,回收其中的CCl4的实验操作名称为____。推测该反应的类型为____。(填标号)
A..分解反应 B.置换反应 C.氧化还原反应 D.离子反应
(2)已知:Si+2NaOH+H2O===Na2SiO3+2H2↑。在高温电炉中碳和SiO2反应可制得SiC,同时生成CO,其粗产品中杂质为Si和SiO2。
①请写出电炉中所发生反应的化学方程式:___________,每有1 mol SiC生成时,转移电子的物质的量为____。
②现将20.0 g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1 mol氢气,过滤得SiC固体11.4 g,滤液稀释到1 L,则硅酸盐的物质的量浓度为______。
(3)下列关于金刚石、SiC和单质Si的说法不正确的是_____。(填标号)
A.金刚石、SiC和单质Si都属于无机非金属材料
B.金刚石和石墨、晶体硅和无定形硅分别互为同素异形体
C.金刚石和单质硅都是良好的半导体材料
D.金刚石、SiC和Si晶体结构类似
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com