


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:


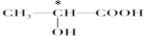
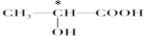
查看答案和解析>>
科目:高中化学 来源: 题型:


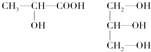
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2012-2013学年云南省芒市中学高二上学期期中考试化学试卷(带解析) 题型:填空题
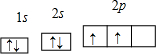
(1)X原子在第二电子层上只有一个空轨道,则X是 ;其轨道表示式为 ;R原子的3p轨道上只有一个未成对电子,则R原子可能是 、 ;Y原子的核电荷数为29,其电子排布式是 ,其在元素周期表中的位置是 ,是属于 区的元素。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_________、__________、________。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。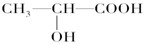
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)________________。
(5) 试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4________H2SO3; H3PO4________H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为 杂化,分子的立体构型为 。
BF3分子中,中心原子的杂化方式为 杂化,分子的立体构型为 。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com