
【题目】下列说法正确的是( )
A.化学反应都伴随着热量的变化
B.个别化学反应与能量变化无关
C.某些吸热反应在不加热条件下也能发生
D.放热反应的发生无需任何条件
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
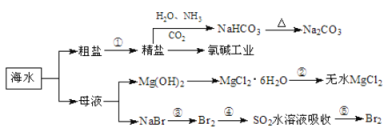
下列有关说法正确的是
A.在第③、④、⑤步骤中,溴元素均被氧化
B.制取NaHCO3的反应是利用其在此反应所涉及物质中溶解度最小
C.用澄清的石灰水可鉴别NaHCO3和Na2CO3
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.18 g D2O和18 g H2O中含有的质子数均为10NA
B.14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃与溴的四氯化碳溶液反应生成CHBr2CBr2CH2CH3 , 则与该烃不同类别的同分异构体是( )
A.CH≡CCH2CH3
B.CH3C≡CCH3
C.CH3CH2CH2CH3
D.CH2=CHCH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(g) △H>0。
CH3OCH3(g) + 3H2O(g) △H>0。
①写出该反应的平衡常数表达式 。
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。
A.容器中密度不变
B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2)︰v(H2)=1︰3
D.容器内压强保持不变
(2)汽车尾气净化的主要原理为:2NO(g) + 2CO (g)![]() 2CO2 (g) + N2 (g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) + N2 (g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
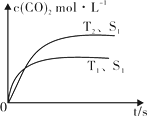
① 该反应的ΔH 0(选填“>”、“<”)。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)已知:CO(g) + 2H2(g)![]() CH3OH(g)△H = ﹣a kJmol-1。
CH3OH(g)△H = ﹣a kJmol-1。
①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4 mol·L-1、c(H2)=0.4 mol·L-1、c(CH3OH)=0.8 mol·L-1, 则此时v正 v逆(填“>”、“<”或“=”)。
②某温度下,在体积固定的2L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则前15分钟,用氢气表示的平均化学反应速率为 ,达到平衡时CO的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,书写正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3 H2O![]() Fe(OH)3↓+3 H+
Fe(OH)3↓+3 H+
B.澄清石灰水与稀盐酸反应Ca(OH)2 + 2 H+ ═ Ca2+ + 2 H2O
C.稀硫酸除铁锈:Fe2O3 + 6 H+ == 2 Fe3+ + 3 H2O
D.硫酸和Ba(OH)2反应: Ba2+ + OH- + SO42- + H+ = BaSO4↓ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3溶液中滴中KSCN溶液变血红色,是因为发生了下列反应,FeCl3+3KSCNFe(SCN)3+3KCl,向该平衡体系中加入少量KCl固体,红色将( )
A.变浅
B.变深
C.不变
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g)![]() CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H________(填“增大”、“减小”或“不变”),判断的理由是________。
CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H________(填“增大”、“减小”或“不变”),判断的理由是________。
(2)CO2制备甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH=-49.0kJ·mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如右图所示。
CH3OH(g)+H2O(g)ΔH=-49.0kJ·mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如右图所示。
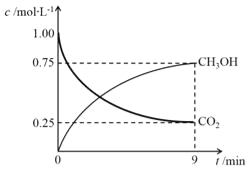
①该反应化学平衡常数K的表达式是________。
②0~9min时间内,该反应的平均反应速率ν(H2)=________。
③在相同条件下,密闭容器的体积缩小至0.5L时,此反应达平衡时放出的热量(Q)可能是________(填字母序号)kJ。
a.0<Q<29.5
B.29.5<Q<36.75
C.36.75<Q<49
D.49<Q<98
④在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如右图所示,L和X分别表示温度或压强。
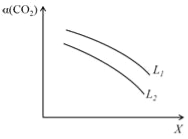
X表示的物理量是。判断L1与L2的大小关系。
(3)科学家用氮化镓材料与铜组装如右图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.
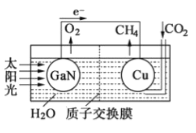
写出铜电极表面的电极反应式,为提高该人工光合系统的工作效率,可向装置中加入少量(选填“盐酸”或“硫酸”).
(4)利用CO2和NH3为原料也合成尿素,在合成塔中的主要反应可表示如下:
反应①:2NH3(g)+CO2(g)=NH2CO2NH4(s)△H1=__________________
反应②:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H2=+72.49kJ·mol-1
总反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-86.98kJ·mol-1;
则反应①的△H1=_______________。
(5)现将amol铁和bmol铜的混合物与含有cmolHNO3的稀溶液充分反应,设还原产物为NO。下列结论不正确的是(填序号)
A.若剩余金属0.5amol,则氧化产物为一种或二种
B.若只有一种氧化产物,则3c=8a
C.若有二种氧化产物,被还原的硝酸物质的量为0.25cmol
D.若有三种氧化产物,被还原的硝酸物质的量为0.25cmol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离 子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )mol/L
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com