
| A. | C(g)的浓度与缩小体积前的平衡浓度相等 | |
| B. | 平衡时,单位时间内n(A)消耗:n(C)消耗=1:1 | |
| C. | 若保持体积不变,向平衡体系中加入少量的A,平衡不移动 | |
| D. | 若开始时向容器中加入1 mol B和1 molC,达到平衡时吸收热量Q kJ |
分析 A、因容器保持恒温,缩小容器体积,达到新平衡时平衡常数不变,则气体C的浓度也一定不变;
B、单位时间内n(A)消耗=n(C)消耗说明正反应速率和逆反应速率相等,当正逆反应速率相等时,反应达到平衡状态;
C、A为固体,加入A对平衡无影响;
D、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时不能完全消耗,放出热量小于Q.
解答 解:A、B为气体,因容器保持恒温,缩小容器体积,达到新平衡时平衡常数不变,则气体C的浓度也一定不变,故A正确;
B、单位时间内消耗n(A)与消耗n(C)相等,说明正逆反应速率相等,反应达到平衡状态,故B正确;
C、A为固体,所以加入少量的A,平衡不移动,故C正确;
D、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时转化率一定小于100%,因此放出热量小于Q,故D错误;
故选D.
点评 本题考查化学平衡影响因素的分析判断,化学判断移动原理的理解设计解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 25℃,1L pH=1的硫酸溶液中含有H+的数为0.2NA | |
| B. | 标准状况下,11.2L NO与11.2L O2混合所含分子数为0.75NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO3 2-)=1mol/L,则Na+个数为2NA | |
| D. | 电镀铜,阳极减少32g,则电路中转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol.L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-) | |
| B. | O.lmol.LNaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-) | |
| C. | 等物质的量NH4Cl和 NaCl 的混合溶液:c(NH4+)+c(NH3.H20)+c(Na+)=2c(Cl-) | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的Na2CO3溶液:c(HCO3-)+2c(H2CO3)=(10-2-10-12)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 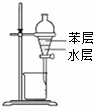 用图所示装置分离苯和水 | |
| B. | 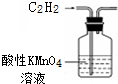 用图所示装置除去C2H2中含有的少量H2S | |
| C. | 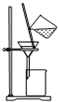 用图所示装置分离NaCl和CaCl2的混合溶液 | |
| D. | 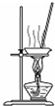 用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L氧气与金属钠完全反应,转移的电子数一定是4NA | |
| B. | 常温常压下,1.7gH2O2中含有电子数为0.9NA | |
| C. | 1L 0.2 mol•L-1 FeCl3溶液中,含有Fe3+粒子数为0.2 NA | |
| D. | 标准状况下,0.1mol 甲苯所含C-C键数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
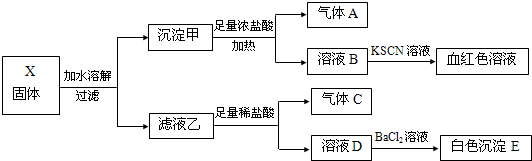
| A. | 固体X中一定含有Fe2O3 | |
| B. | 沉淀E可能含有BaSO3 | |
| C. | 气体A、C一定均为纯净物 | |
| D. | 固体X可能出现含有K2SO3、K2CO3而不含Na2SO4的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl(NH4Cl):加热 | B. | FeCl2(FeCl3):铁粉 | ||
| C. | AlCl3(MgCl2):加氨水 | D. | Fe2O3(Al2O3):加氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com