
��7�֣��ϳ�������Ҫ�ɷ���һ����̼�������������ںϳɶ����ѵ����ȼ�ϣ�����Ȼ����úϳ��������п��ܷ����ķ�Ӧ�У�
��CH4��g��+H2O��g��?CO��g��+3H2��g����H1=+206��1kJ/mol
��CH4��g��+CO2��g��?2CO��g��+2H2��g����H2=+247��3kJ/mol
��CO��g��+H2O��g��?CO2��g��+H2��g����H3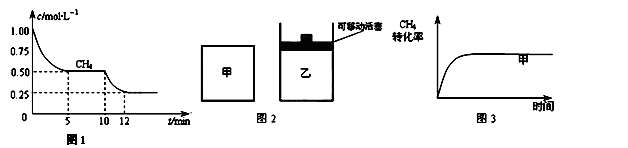
��ش��������⣺
��1����һ�����ܱ������н��з�Ӧ�٣����CH4�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ1��ʾ����Ӧ���е�ǰ5min�ڣ� ��H2��= ��10minʱ���ı��������������� ��
��H2��= ��10minʱ���ı��������������� ��
��2����ͼ2��ʾ���ڼס����������зֱ��������ʵ�����CH4��CO2��ʹ�ס�����������ʼ�ݻ���ȣ�����ͬ�¶��·�����Ӧ�ڣ���ά�ַ�Ӧ�������¶Ȳ��䣮��֪��������CH4��ת������ʱ��仯��ͼ����ͼ3��ʾ������ͼ3�л�����������CH4��ת������ʱ��仯��ͼ��
��3����Ӧ���С�H3= ��800��ʱ����Ӧ�۵Ļ�ѧƽ�ⳣ��K=1��0��ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ������±���
| CO | H2O | CO2 | H2 |
| 0��5mol | 8��5mol | 2��0mol | 2��0mol |
��1�� 0��3mol/��L?min�� �����¶�
��2��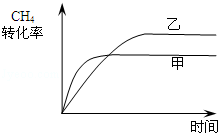 ��
��
��3����41��2kJ/mol a
���������������1����ͼ1��֪��ǰ5min�ڼ����Ũ�ȱ仯Ϊ0��50 mol��L��1������v=��c/��t����v(CH4)= 0��1mol/��L?min����Ϸ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȼ���ɵ�v(H2)= 0��3mol/��L?min����ע��д�嵥λ����ͼ1��֪��10minʱ�����Ũ�ȼ�����С���÷�Ӧ������Ӧ�����ƶ������÷�ӦΪ���ȷ�Ӧ����ı����������Ϊ�����¶ȡ���2����ͼ1�������֪�������ķ�Ӧ����Ϊ���µ��ݣ��������ķ�Ӧ����Ϊ���µ�ѹ���ס����������зֱ��������ʵ�����CH4��CO2���Ҽס�����������ʼ�ݻ���ȣ���������䣬�ҵ�ѹǿ���䣬��ٶ��ײ��䣬���з���CH4��g��+CO2��g��?2CO��g��+2H2��g����������������൱��ѹǿ��С����ѧƽ��������Ӧ�����ƶ�����������CH4��ת��������ѹǿС����Ӧ���ʼ�������ﵽƽ���ʱ��䳤���ɴ˿ɻ���ͼ��3�����ݸ�˹���ɿ�֪����-�ڿɵ÷�Ӧ�ۣ����H3=+206��1kJ/mol-��+247��3kJ/mol��=-41��2kJ/mol��800��ʱ����Ӧ�۵�K=1��0ʱ������������ͬһ�ܱ������У������ͬ�������ʵ�����Ũ�ȳ����ȣ��ɱ����е����ݼ����Q��K���÷�Ӧ������Ӧ�����ƶ���������Ӧ���ʴ����淴Ӧ���ʣ���ѡa��
���㣺���黯ѧ��Ӧ���ʵļ��㣬��ѧƽ����ƶ�����Ӧ������жϡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij�о�С���һԪ�л�����HA���ܼ�����ˮ�Ļ����ϵ�е��ܽ�̶Ƚ����о�����25��ʱ������HA��ˮ�в��ֵ��룬��HAŨ��Ϊ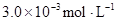 ʱ��������Ϊ0.20������ȣ��ѵ����HA������/��ʼHA���ܷ����������ڱ��в��ַ���˫�ۣ����ɣ�HA��2����ƽ����ϵ�У�һԪ�л�����HA���ܼ�����B����ˮ��W���еķ���ϵ��ΪK��K��C��HA��B��C��HA��W��1.0�����ﵽƽ����Է�����ʽ���ڵ�HA�ڱ���ˮ�����ܼ��еı���Ϊ1��1��������Ϣ���£�
ʱ��������Ϊ0.20������ȣ��ѵ����HA������/��ʼHA���ܷ����������ڱ��в��ַ���˫�ۣ����ɣ�HA��2����ƽ����ϵ�У�һԪ�л�����HA���ܼ�����B����ˮ��W���еķ���ϵ��ΪK��K��C��HA��B��C��HA��W��1.0�����ﵽƽ����Է�����ʽ���ڵ�HA�ڱ���ˮ�����ܼ��еı���Ϊ1��1��������Ϣ���£�
| 25��ƽ����ϵ | ƽ�ⳣ�� | �ʱ� | ��ʼ��Ũ�� |
��ˮ�У�HA 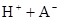 | 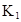 | 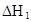 | 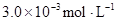 |
�ڱ��У�2HA 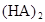 | 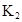 | 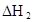 | 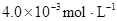 |
 ��HA��2����Ӧ�ڽϵ��¶����Է����У���
��HA��2����Ӧ�ڽϵ��¶����Է����У���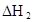 ___________0��
___________0��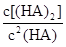 ��130����Ӧ��___________������С�
��130����Ӧ��___________������С��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ij�¶��£�����㶨���ܱ������м���2 molN2��4 molH2���������·�Ӧ��
N2(g)+3H2(g) 2NH3(g)����H����92.4 kJ/mol���ﵽƽ��ʱ���ų�����46.2 kJ����
2NH3(g)����H����92.4 kJ/mol���ﵽƽ��ʱ���ų�����46.2 kJ����
��1���ﵽƽ��ʱ��N2��ת����Ϊ_______________, NH3���������Ϊ ��
��2������������м���a mol N2��b mol H2��c mol NH3����a��b��c��Ϊ����������ͬ�����´ﵽƽ��ʱ��������и���ֵ����ʵ���������ƽ����ͬ��a��b��cȡֵ���������һ�������� , ��
��3����ѧ�ҷ�����ʹNH3ֱ������ȼ�ϵ�صķ�������װ���ò������缫������������Һ�У�һ���缫ͨ���������һ�缫ͨ��NH3�������ܷ�ӦʽΪ��4NH3+3O2��2N2+6H2O���������ҺӦ���� ������������������ԡ� �������ԡ� ���ԡ� ����д�������ĵ缫��Ӧ����ʽ������������������ ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�о�NO2����CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
���÷�Ӧ6NO2(g)��8NH3(g) 7N2(g)��12 H2O(g)�ɴ���NO2��700��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������NO2��NH3, ��Ӧ�����вⶨ�IJ������ݼ��±�
7N2(g)��12 H2O(g)�ɴ���NO2��700��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������NO2��NH3, ��Ӧ�����вⶨ�IJ������ݼ��±�
| ��Ӧʱ��/min | n(NO2)/mol | n(NH3)/ mol |
| 0 | 1.20 | 1.60 |
| 2 | 0.90 | |
| 4 | | 0.40 |
 CH3OH��g����200��ʱ������һ�����������ܱ�����������г���һ������CO��H2����������Ӧ,ѹ���������ݻ�Ϊԭ����һ�룬ƽ�⽫ �ƶ������������ң�������CO��Ũ�Ƚ� ������С�����䣩
CH3OH��g����200��ʱ������һ�����������ܱ�����������г���һ������CO��H2����������Ӧ,ѹ���������ݻ�Ϊԭ����һ�룬ƽ�⽫ �ƶ������������ң�������CO��Ũ�Ƚ� ������С�����䣩�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�跴Ӧ��Fe(s)+CO2(g) FeO(s)+CO(g)��H=Q1��ƽ�ⳣ��ΪK1��
FeO(s)+CO(g)��H=Q1��ƽ�ⳣ��ΪK1��
��Ӧ��Fe(s)+H2O(g) FeO(s)+H2(g)��H=Q2��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
FeO(s)+H2(g)��H=Q2��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
| �¶�(T) | K1 | K2 |
| 973 | 1��47 | 2��38 |
| 1173 | 2��15 | 1��67 |
 CO(g)+H2O(g)��H=Q3
CO(g)+H2O(g)��H=Q3�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���û�ѧ��Ӧԭ���о�������ȵ��ʼ��仯����ķ�Ӧ����Ҫ����
��1����������������2SO2(g)��O2(g) 2SO3(g)��ƽ������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ��ͼ
2SO3(g)��ƽ������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ��ͼ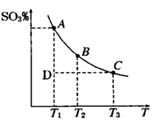 ��ʾ������ͼ�ش��������⣺
��ʾ������ͼ�ش��������⣺
��2SO2(g)+O2(g) 2SO3(g)�ġ�H__________0���������������
2SO3(g)�ġ�H__________0���������������
��һ�������£���SO2��O2�������2:1����һ���������ܱ������з������Ϸ�Ӧ����˵���÷�Ӧ�Ѵﵽƽ����� ��
a����ϵ���ܶȲ������仯
b��SO2��SO3������ȱ��ֲ���
c����ϵ����Ԫ�ص������ٷֺ������ٱ仯
d����λʱ����ת��4 mol ���ӣ�ͬʱ����2 mol SO3
e�������ڵ���������������ٱ仯
��2��һ���������£��ϳɰ���ӦΪ��N2(g)+3H2(g) 2NH3(g)��ͼ1��ʾ�ڴ˷�Ӧ�����е������ı仯��ͼ2��ʾ��2L���ܱ������з�ӦʱN2�����ʵ�����ʱ��ı仯���ߡ�ͼ3��ʾ�������������������£��ı���ʼ�����������ʵ����Դ˷�Ӧƽ���Ӱ�졣
2NH3(g)��ͼ1��ʾ�ڴ˷�Ӧ�����е������ı仯��ͼ2��ʾ��2L���ܱ������з�ӦʱN2�����ʵ�����ʱ��ı仯���ߡ�ͼ3��ʾ�������������������£��ı���ʼ�����������ʵ����Դ˷�Ӧƽ���Ӱ�졣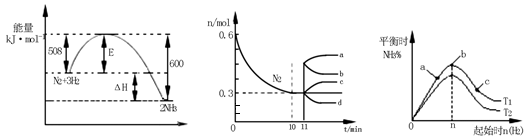
ͼ1 ͼ2 ͼ3
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ �������¶ȣ�ƽ�ⳣ�� �������С�����䡱����
����ͼ2��Ϣ������0��10min�ڸ÷�Ӧ��ƽ������v(H2)�� ����11min�������������䣬ѹ�����������Ϊ1L����n(N2)�ı仯����Ϊ ��
��ͼ3 a��b��c����������ƽ��״̬�У���Ӧ��N2��ת������ߵ��� �㣬�¶�T1 T2�����������������
��3�����������ʵ�����SO2��NH3����ˮ��ַ�Ӧ��������Һ�� �ԣ�������Һ��c��H+���� c��OH������ ����֪��H2SO3��Ka1��1.7��10��2��Ka2��6.0��10��8��NH3��H2O��Kb��1.8��10��5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������ʵ�����A��B�����2L���ܱ������У�������Ӧ��3A(g)+B(g) xC(g)+2D(g) ��H<0��5min��ﵽƽ�⣬ƽ��ʱ���D��Ũ��Ϊ0.5mol/L��C(A)��C(B)=1��2��C��ƽ����Ӧ����Ϊ0.05mol/(L��min)
xC(g)+2D(g) ��H<0��5min��ﵽƽ�⣬ƽ��ʱ���D��Ũ��Ϊ0.5mol/L��C(A)��C(B)=1��2��C��ƽ����Ӧ����Ϊ0.05mol/(L��min)
(l)x��ֵΪ_______________;
(2)A��ƽ��Ũ��____________;
(3)�����º��ݣ���������ƽ��ʱ��ѹǿ����ʼʱ��ѹǿ��___________;
(4)��ͼ��ijһʱ����и÷�Ӧ�����뷴Ӧ���̵����߹�ϵͼ���ش��������⣺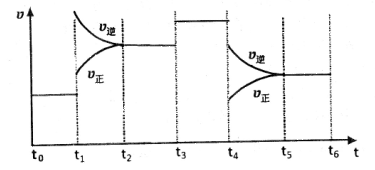
�ٴ���ƽ��״̬��ʱ�����____________��
�� ��
��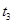 ��
��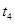 ʱ����ϵ�зֱ���ʲô���������˱仯��
ʱ����ϵ�зֱ���ʲô���������˱仯�� ___________��
___________��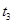 _____________ ��
_____________ ��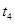 _____________����A-E��
_____________����A-E��
A������ B������ C���Ӵ��� D����ѹ E����ѹ
�����и�ʱ���ʱ��A�����������ߵ���____
A.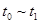 B��
B��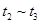 C��
C��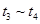 D��
D��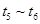
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧ����Դ����������������ʮ�ֹؼ������á�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϡ�
I������ȼ�ϵ������ת���ʸߣ����й����ķ�չǰ������������ȼ�ϵ�ؽ�����ͼʵ�飨ͼ�����õ缫��Ϊ���Ե缫����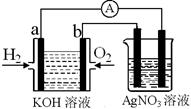
��1����������ȼ�ϵ���У����б��ﲻ��ȷ����________
| A��a�缫�Ǹ�����OH���������� |
| B��b�缫�ĵ缫��ӦΪ��O2��2H2O��4e����4OH�� |
C������ܷ�ӦʽΪ��2H2+O2 2H2O 2H2O |
| D���������Һ��pH���ֲ��� |
 2NH3(g) ��H����92.20 kJ��mol��1��
2NH3(g) ��H����92.20 kJ��mol��1��| ʱ�䣨h�� ���ʵ�����mol�� | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ˮú��ת����ӦCO(g)+H2O(g)  CO2(g)+H2 (g)��һ���¶��´ﵽ��ѧƽ��״̬��
CO2(g)+H2 (g)��һ���¶��´ﵽ��ѧƽ��״̬��
���������գ�
��1��д���÷�Ӧ��ƽ�ⳣ������ʽK=________________��
��2��һ���¶��£���һ���ݻ�������ܱ������з���������Ӧ������˵�������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���� ��ѡ���ţ���
a�������е�ѹǿ���� b��1 mol H��H�����ѵ�ͬʱ����2 molH��O��
c��v��(CO) = v��(H2O) d��c(CO) = c(H2)
��3������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������н��з�Ӧ���õ�����ʵ����1��ʵ����2�����ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 3 |
| 2 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 3 | 950 | 1 | 2 | �� | �� | �� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com