
| A. | CO(NH2)2 | B. | (NH4)2CO3 | C. | NH4NO3 | D. | CH3COONH4 |
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,用pH计测定0.1mol/L的甲酸钠溶液pH为13 | |
| B. | 向饱和醋酸钠溶液中添加0.1mol/L的碳酸钠溶液产生了无色气体 | |
| C. | 少量Mg(OH)2沉淀中加入氯化铵浓溶液可以观其察到白色沉淀溶解 | |
| D. | 向2ml 1mol/L的NaOH溶液中加入3滴 1mol/L MgCl2溶液,再加入3 滴1mol/L FeCl3溶液可以证明Mg(OH)2沉淀转变成Fe(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构特点及元素、单质、化合物的性质 |
| X | 气态氢化物与最高价氧化物对应水化物可以化合成盐 |
| Y | 原子中s电子数与p电子数相同,且p电子的能量最高 |
| Z | 单质在空气中燃烧产生黄色火焰,生成黄色粉末 |
| W | 最外层电子排布(n+1)sn(n+1)pn-1 |
| T | 单质升华可以产生紫色的烟 |
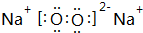 ;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.
;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
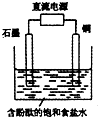
| A. | 铜电极上发生还原反应 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 溶液中的Na+向石墨电极移动 | D. | 铜电极附近观察到黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
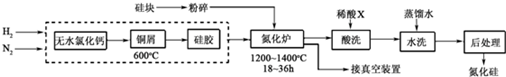
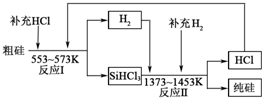
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,15g甲基(-CH3)所含的中子数为6NA | |
| B. | 一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO32-)=1mol/L,则Na+个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 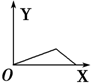 | B. | 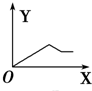 | C. | 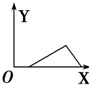 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe3+、NO3-、K+ | B. | Al3+、Na+、Cl-、SO42- | ||
| C. | Na+、Ba2+、NO3-、Cl- | D. | K+、Na+、Cl-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com