
【题目】下列叙述中正确的是( )
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.能与酸反应的氧化物,一定是碱性氧化物
C.含金属元素的离子不一定都是阳离子
D.金属阳离子被还原后,一定得到该元素的单质
科目:高中化学 来源: 题型:
【题目】把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连可以组成各种原电池.若a、b相连时,a为负极;c、d相连时,d上有气泡逸出;a、c相连时,a极减轻;b、d相连时,b为正极.则这四种金属活泼性顺序由强到弱的顺序为( )
A.a>b>c>d
B.a>c>b>d
C.a>c>d>b
D.b>d>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
(1)高铁电池的负极材料是____。
(2)放电时,正极发生____(填“氧化”或“还原”)反应;已知负极反应为Zn-2e-+2OH-====Zn(OH)2,则正极反应为_______________________。
(3)放电时,____(填“正”或“负”)极附近溶液的碱性增强。
II、在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,回答下列问题:
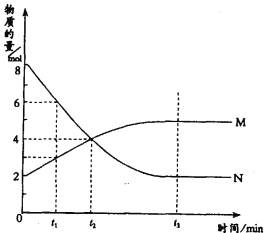
(4)反应的化学方程式为:______________。
(5)反应在_______时刻达到平衡状态。
(6)反应在_____时刻之前正反应速率大于逆反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是( )
A.原子序数:X<Y
B.原子半径:X<Y
C.离子半径:X>Y
D.最外层电子数:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸是实验室及生活中的常见物质。
(1)写出醋酸的电离方程式______________。
(2)常温下醋酸溶液的pH <7,用文字描述其原因是____________。
(3)能证明醋酸是弱酸的实验事实是(多选、错选不得分)_________。
a.同浓度的CH3COOH溶液和盐酸分别与相同的Mg条反应,放出H2的初始速率醋酸慢
b.0.1 mol·L-1 CH3COONa溶液的pH> 7
c.CH3COOH溶液与Na2CO3反应生成CO2
d.0.1 mol·L-1 CH3COOH溶液可使紫色石蕊变红
e. 常温下0.1mol/l醋酸溶液的pH>1
(4)25 ℃时,在体积均为20 mL、浓度均为0.1 mol·L-1的CH3COOH、HCl溶液中,分别逐滴加入浓度为0.1 mol·L-1的NaOH溶液,溶液pH随加入NaOH溶液体积变化如图所示。
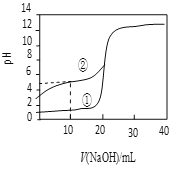
ⅰ.当加入NaOH溶液20 ml时,①溶液的离子浓度大小关系是____________ 。
ⅱ.当②溶液的pH=7时,溶液中存在的微粒浓度大小关系正确的是____________。
a.c(Na+)=c(Ac-)>c(HAc)>c(H+)=c(OH-)
b.c(Na+)=c(Ac-)>c(H+)=c(OH-)>c(HAc)
c.c(HAc)>c(Na+)=c(Ac-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )
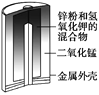
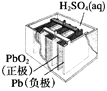
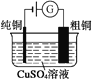
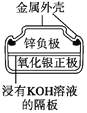
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A. 图1所示电池中,MnO2的作用是催化剂
B. 图2所示电池放电过程中,硫酸浓度不断增大
C. 图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=![]() ,它所对应的化学反应为:__________________。
,它所对应的化学反应为:__________________。
(2)已知在一定温度下,
①C(s)+CO2(g)![]() 2CO(g) ΔH1=a kJ/mol 平衡常数K1;
2CO(g) ΔH1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g)![]() CO(g)+H2(g) ΔH3 平衡常数K3。
CO(g)+H2(g) ΔH3 平衡常数K3。
则K1、K2、K3之间的关系是________,ΔH3=__________________(用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是______反应(填“吸热”或“放热”),若在500 ℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为________。
(4)高炉炼铁产生的废气中的![]() 可进行回收,使其在一定条件下和
可进行回收,使其在一定条件下和![]() 反应制备甲醇:
反应制备甲醇: ![]() 。请回答下列问题;
。请回答下列问题;
①若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 |
| 能量变化( |
甲 | 1 |
|
| 放出 |
乙 | 1 |
|
| 放出 |
丙 | 2 |
|
| 放出 |
则下列关系正确的是__________。
a. ![]() b.
b. ![]() c.
c. ![]() d.
d. ![]()
e.该反应若生成1![]()
![]() ,则放出(
,则放出(![]() 热量
热量
②若在一体积可变的密闭容器中充入1![]()
![]() 、2
、2![]()
![]() 和1
和1![]()
![]() ,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________(填“正”或“逆”)反应方向移动。
,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________(填“正”或“逆”)反应方向移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com