
| A、判断皂化反应是否完全,可取反应后的混合液滴入热水中 |
| B、减压过滤不宜过滤胶状沉淀或颗粒太小的沉淀 |
| C、制备硫酸亚铁铵晶体,需加热至大量晶体析出并剩余少量液体即停止加热 |
| D、易燃试剂与强氧化性试剂需分开放置,并远离火源;金属着火时可用细沙覆盖灭火 |


科目:高中化学 来源: 题型:
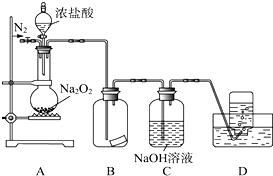 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下:
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下: Na2O2+
Na2O2+ HCl═
HCl═ Cl2+
Cl2+ NaCl+
NaCl+
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 |
| B、H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 |
| C、在H2O2分解过程中,溶液的pH逐渐下降 |
| D、H2O2生产过程中加入少量Fe2+可以提高产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14.2g | B、4.24g |
| C、11.44 | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称量5.85 g氯化钠固体 |
| B、从试剂瓶中取Na2CO3溶液,发现取量过多,为了不浪费,把过量的试剂倒入原试剂瓶中 |
| C、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
| D、用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com