
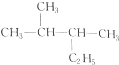
 与
与
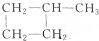 与
与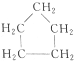
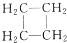 与
与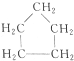
分析 同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;
具有相同分子式而结构不同的化合物互为同分异构体;
同种元素形成的不同单质互为同素异形体;
质子数相同质量数(或中子数)不同的原子互称同位素;
组成和结构都相同的物质为同一物质,同一物质组成、结构、性质都相同,结构式的形状及物质的聚集状态可能不同.
解答 解:A.Al(OH)3与H3AlO3书写形式不同,结构相同,为同一种物质;
B. 与
与 名称与结构简式一致,为同一种物质;
名称与结构简式一致,为同一种物质;
C.金刚石与石墨由碳元素组成的不同单质,互为同素异形体;
D. 与
与 分子式相同,结构不同,互为同分异构体;
分子式相同,结构不同,互为同分异构体;
E.CH3-CH=CH2是烯烃,CH4是烷烃,不存在关系;
F.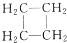 与
与 都是环烷烃,结构相似,相差1个CH2原子团,互为同系物;
都是环烷烃,结构相似,相差1个CH2原子团,互为同系物;
故答案为:C;F;D;AB;
点评 本题考查“五同”比较,难度不大,侧重考查学生的辨别能力,注意概念的掌握,要细心排查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤中含有苯和甲苯,可用分馏的方法把它们分离出来 | |
| B. | 煤气的主要成分是丁烷 | |
| C. | 石油是混合物,其分馏产品汽油为纯净物 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | H2SO4 | C. | AgNO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
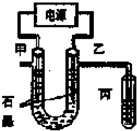 CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
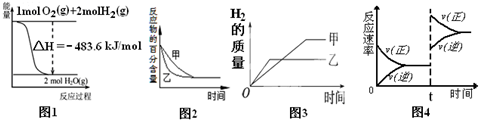
| A. | 图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ/mol | |
| B. | 图2表示压强对可逆反应2A(g)+2 B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 | |
| C. | 图3表示等质量的钾、钠分别与足量水反应,则甲为钠 | |
| D. | 图4表示达到化学平衡后,在t时刻增加了反应物的浓度后,正逆反应速率的变化情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ 1s22s22p6 | B. | F?1s22s22p6 | C. | N3+ 1s22s22p6 | D. | O2?1s22s22p6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com