
| A. | 溶液浓度为0.1 mol/L | B. | 稀释至100 mL时,pH=11 | ||
| C. | 加入少量NH4Cl固体,c(OH-)不变 | D. | 加入少量NaOH固体,c(NH4+)减小 |
分析 A、pH=13的氨水,则c(OH-)=0.1 mol/L,而氨水是弱碱,所以溶液浓度大于0.1 mol/L;
B、稀释过程中氨水电离,所以pH减少不到两个单位;
C、加入少量NH4Cl固体,发生同离子效应;
D、加入少量NaOH固体,对氨水的电离平衡起抑制作用.
解答 解:A、pH=13的氨水,则c(OH-)=0.1 mol/L,而氨水是弱碱,所以溶液浓度大于0.1 mol/L,而不是等于0.1 mol/L,故A错误;
B、稀释过程中氨水电离,所以pH减少不到两个单位,所以稀释至100 mL时,pH>11,故B错误;
C、加入少量NH4Cl固体,铵根离子浓度变大,氨水的电离平衡逆向移动,所以氢氧根离子浓度减小,故C错误;
D、加入少量NaOH固体,对氨水的电离平衡起抑制作用,平衡逆向移动,c(NH4+)减小,故D正确;
故选D.
点评 本题考查了pH的计算,明确氨水是弱电解是解本题关键,再结合弱电解质电离特点分析解答,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
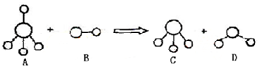
| A. | 分子C 中存在π键 | |
| B. | 微粒A 的空间结构与CH4相似,它们均为正四面体,所以它是非极性分子 | |
| C. | 固态D 的于熔沸点明显高于固态H2S 的原因在于D 分子中的共价键强于S-H 键 | |
| D. | D 分子呈V 形与其分子中存在孤对电子有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuS<Cu(OH)2<CuCO3 | B. | CuS>Cu(OH)2>CuCO3 | C. | Cu(OH)2>CuCO3>CuS | D. | Cu(OH)2>CuCO3>CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子交换法淡化海水发生了化学变化 | |
| B. | 海水淡化可为人类提供更多的淡水资源 | |
| C. | 利用太阳能蒸发原理淡化海水属于物理变化 | |
| D. | 将海水中的盐分离出来不能达到海水淡化的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物柴油是可再生能源 | |
| B. | 发展生物柴油也有益于保护生态环境 | |
| C. | 生物柴油的组成成分与矿物柴油完全相同 | |
| D. | 发展生物柴油有利于调整产业结构、增加农民收入 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)?2NO(g)△H;
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)?2NO(g)△H;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com