
在一密闭容器中发生反应N2+3H2 2NH3 , ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
2NH3 , ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:

回答下列问题:
(1)处于平衡状态的时间段是__________(填选项)。
A t0~t1 B t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项),t1时刻________; t4时刻________。
A 增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__________(填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为__________。
(1) ACDF (2)C;B。 (3) A (4)5:6
【解析】
试题分析:(1)当正反应速率等于逆反应速率时,反应达到化学平衡,根据图像可知,t0~t1、t2~t3、t3~t4、t5~t6,正反应速率等于逆反应速率,故答案为:ACDF。
(2)t1时正、逆反应速率都增大,平衡向逆反应方向移动,因为该反应的正反应为放热反应,所以升高温度,正、逆反应速率都增大,平衡向逆反应方向移动,故t1时刻改变的条件是升高温度;t4时刻正、逆反应速率都减小,平衡向逆反应方向移动,因为该反应正反应方向气体系数减小,所以减小压强,正、逆反应速率都减小,平衡向逆反应方向移动,故t4时刻改变的条件是减小压强。
(3)因为t0~t1、t2~t3、t3~t4、t5~t6,处于化学平衡状态,t1~t2、t4~t5,平衡向逆反应方向移动,所以氨的百分含量最高的是t0~t1。
(4)设反应前加入amol N2、bmol H2,达到平衡时生成2xmol NH3,则反应前混合气体总物质的量=(a+b)mol,反应后混合气体总物质的量=(a+b—2x),根据平衡时混合气体中氨气的体积分数为20%,可得:2x÷(a+b—2x)=0.2,解得a+b=12x,所以反应后与反应前的混合气体体积之比=(a+b—2x):(a+b)=(12x—2x):12x=5:6。
考点:本题考查图像的分析、化学平衡的判断、平衡移动的影响因素及应用、化学平衡的计算。


科目:高中化学 来源:2014-2015学年甘肃甘谷县第一中学高一上学期第一次月考化学试卷(解析版) 题型:填空题
(每空2分,共16分)实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液480 mL:
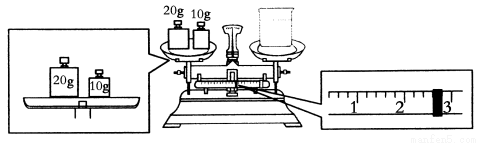
(1)配制时,必须使用的玻璃仪器有________、________、________、________。
(2)要完成本实验该同学应称出NaOH________g。
(3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为________g。
(4)使用容量瓶前必须进行的一步操作是________。
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________。
①没有洗涤烧杯和玻璃棒 ②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:选择题
在密闭容器中进行如下反应:X2(g)+Y2(g) 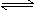 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A.Z为0.3 mol/L B.Y2为0.4 mol/L
C.X2为0.2 mol/L D.Z为0.4 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南长沙市高三上学期第二次月考化学试卷(解析版) 题型:选择题
含有下列各组离子的溶液中通入(或加入)过量的某种物质后仍能大量共存的是
A.H+、Ba2+、Fe3+、NO3-,通入SO2气体
B.Ca2+、Cl-、K+、H+,通入CO2气体
C.AlO2-、Na+、Br-、SO42-,通入CO2气体
D.HCO3-、Na+、I-、HS-,加入AlCl3溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南长沙市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列各组物质,不能按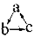 (“→”表示反应一步完成)关系转化的是
(“→”表示反应一步完成)关系转化的是
选项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南邵阳县石齐学校高二上第一次月考化学(理)试卷(解析版) 题型:选择题
化学平衡状态I、II、III的相关数据如下表:
编号 | 化学方程式 | 平衡常数 | 温度 | |
979K | 1173K | |||
I | Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
Ⅱ | CO(g)+H2O(g) | K2 | 1.62 | b |
Ⅲ | Fe(s)+H2O(g) | K3 | a | 1.68 |
根据以上信息判断,下列结论错误的是
A.a>b
B.增大压强,平衡状态II不移动
C.升高温度平衡状态III向正反应方向移动
D.反应II、III均为放热反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南邵阳县石齐学校高二上第一次月考化学(理)试卷(解析版) 题型:选择题
设C+CO2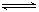 2CO △H > 0 反应速率为?1,N2+3H2
2CO △H > 0 反应速率为?1,N2+3H2 2NH3 △H<0 反应速率为?2,对于上述反应,当温度升高时,?1和?2的变化情况为
2NH3 △H<0 反应速率为?2,对于上述反应,当温度升高时,?1和?2的变化情况为
A. 同时增大 B.同时减小 C.增大,减小 D.减小,增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省衡阳市高二上学期期中考试化学试卷(解析版) 题型:填空题
(16分)Ⅰ、现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨三角漏斗。有下列药品:①NaOH固体;②0.1000mol/L的标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液。试回答以下问题。
(1)做酸碱中和滴定时,还缺少的试剂是 (全对得分,下同)
(2)配制250mL0.1000mol/LNaOH溶液时,还缺少的仪器是 。
(3)过滤时,应选用上述仪器中的 (填编号)
Ⅱ、为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在 (填“酸式滴定管”或“碱式滴定管” )中,达到滴定终点的现象为 。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度_ _ (填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为 mol/L。
(4)在该溶液与KOH溶液反应所得的0.1 mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4),下列关系正确的是 。
A. c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B.c (HC2O4-)+ c (C2O42-)+ c(H2C2O4)=0.1mol/L
C. c(H+)<c(OH-)
D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
选项化合物 | A | B | C | D |
Y | CO2 | Fe2O3 | SiO2 | FeCl3 |
W | MgO | Al2O3 | CO | CuCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com