
| A、工业制取漂白粉:2Cl2+4OH-=2Cl-+2ClO-+2H2O | ||
B、向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++HCO
| ||
| C、硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+═Fe3++4H2O | ||
| D、铝粉与NaOH的D2O溶液反应:2Al+2OH-+2D2O═2AlO2-+3D2↑ |


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
| A、1mol硝基(-NO2)与NA个二氧化氮气体分子所含电子数相等 |
| B、1mol氢氧根离子(OH-)与NA个羟基(-OH)所含电子数相等 |
| C、在相同温度下,pH=1且体积为1L的硫酸溶液所含氢离子数与pH=13且体积为1L的氢氧化钠溶液所含氢氧根离子数一定均为0.1NA |
| D、在反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中,每生成1molO2该反应共转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②⑥ | C、③④ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
| B、常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H<0 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、常温下,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
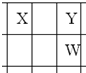 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示.下列说法正确的是( )| A、五种元素中,原子半径最大的是W |
| B、Y的简单阴离子比W的简单阴离子还原性强 |
| C、Y与Z形成的化合物都可以和盐酸反应 |
| D、X与Q形成的化合物是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
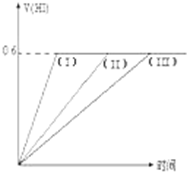 在一定温度下发生反应:I2(g)+H2(g)?2HI(g);并达平衡.HI的体积分数V(HI)%随时间变化如图曲线(II)所示.若改变反应条件,在甲条件下的变化如曲线(I)所示.在乙条件下的变化如曲线(III)所示.则甲条件、乙条件分别是( )
在一定温度下发生反应:I2(g)+H2(g)?2HI(g);并达平衡.HI的体积分数V(HI)%随时间变化如图曲线(II)所示.若改变反应条件,在甲条件下的变化如曲线(I)所示.在乙条件下的变化如曲线(III)所示.则甲条件、乙条件分别是( ) | A、①⑤,③ | B、②⑤,④ |
| C、③⑤,② | D、③⑤,④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
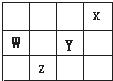
| A、四元素中,X的单质最稳定 |
| B、氢化物稳定性:HY>H2Z |
| C、原子半径:W>Y |
| D、W在周期表中的位置为:第2周期第5族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com