
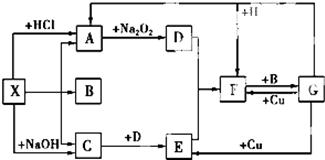
 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1molX分解得到A、B、C各1mol.试回答下列各题:
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1molX分解得到A、B、C各1mol.试回答下列各题:分析 常温下X是固体,X既能与酸反应生成气体A,又能与碱反应生成气体C,故X应为弱酸的铵盐,则气体C为NH3,气体A能与Na2O2反应得到气体D,则A为CO2,D为O2,氨气与氧气反应生成气体E为NO,NO与氧气反应生成气体F为NO2,1molX分解得到A、B、C各1mol,且B为液体,则X是NH4HCO3,B为H2O.液体G与Cu反应可以得到NO、NO2,而NO2与水反应得到G,故G为HNO3,则固体H为碳.
解答 解:常温下X是固体,X既能与酸反应生成气体A,又能与碱反应生成气体C,故X应为弱酸的铵盐,则气体C为NH3,气体A能与Na2O2反应得到气体D,则A为CO2,D为O2,氨气与氧气反应生成气体E为NO,NO与氧气反应生成气体F为NO2,1molX分解得到A、B、C各1mol,且B为液体,则X是NH4HCO3,B为H2O.液体G与Cu反应可以得到NO、NO2,而NO2与水反应得到G,故G为HNO3,则固体H为碳.
(1)由上述分析可知,X为NH4HCO3,B为H2O,故答案为:NH4HCO3;H2O;
(2)①H+G→A+F的化学方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
②C+D→E的化学方程式:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
(3)反应G+Cu→E的离子方程式:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,
故答案为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O;
(4)由于NH3易液化,工业上合成氨气,合成后采用加压降温液化方法从混合气体中分离出氨气,
故答案为:NH3易液化.
点评 本题考查无机物的推断,侧重于学生的分析能力和推断能力的考查,注重于元素化合物知识的综合运用,最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等.


科目:高中化学 来源: 题型:选择题
| A. | 将Al条投入NaOH溶液中:Al+OH-+H2O═[Al(OH)4]-+H2↑ | |
| B. | 向氯化铵的稀溶液中加入少量NaOH NH4++OH-═NH3↑+H2O | |
| C. | 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 向浓硝酸中加入铜片Cu+4H++2N03-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
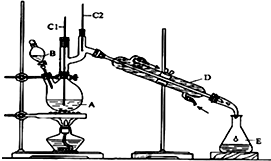 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:| 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水应保存在棕色瓶中 | B. | 少量金属钠保存在煤油中 | ||
| C. | 漂白粉可露置于空气中保存 | D. | 液溴采用液封法保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铝粉投入溶液中会产生氢气:Mg2+、NO3-、K+、SO42- | |
| B. | 滴加石蕊试液会使溶液变蓝:Na+、Al3+、CO32-、NO3- | |
| C. | 将锌粒投入溶液中会产生氢气:Ca2+、Cl-、Mg2+、NH4+ | |
| D. | 溶液能使淀粉碘化钾试纸变蓝NH4+、CO32-、Cl-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂 | |
| B. | 上述反应中每生成2molAlN,N2得到3mol电子 | |
| C. | 氮化铝中氮元素的化合价为-3 | |
| D. | 氮化铝是铝合金中的一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ; B的结构简式CH3CH2CHO;B的物质的量0.06mol;
; B的结构简式CH3CH2CHO;B的物质的量0.06mol; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com