
【题目】已知:金属铁(含杂质碳)在酸性溶液中发生析氢腐蚀,总反应方程式为:Fe+2H+═Fe2++H2↑;铁在中性或碱性溶液中发生吸氧腐蚀,总反应式为:4Fe+3O2+6H2O═4Fe(OH)3↓.某课外活动小组,将剪下的一块铁片放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )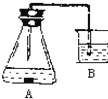
A.铁被腐蚀
B.B中导气管里形成一段水柱
C.金属片剪口处变红
D.B中导气管中产生气泡
【答案】D
【解析】金属铁(含杂质碳),放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,形成的原电池中,金属铁为负极,发生反应:Fe﹣2e﹣=Fe2+ , 碳为正极,发生吸氧腐蚀,即2H2O+O2+4e﹣=4OH﹣ , 所以锥形瓶中气体压强减小,生成的氢氧根离子遇到酚酞会显示红色.A、形成的原电池中,金属铁为负极,发生反应:Fe﹣2e﹣=Fe2+ , 所以A正确;B、锥形瓶中金属发生吸氧腐蚀,瓶中气体压强减小,导气管里形成一段水柱,所以B正确;C、锥形瓶中金属发生吸氧腐蚀,生成的氢氧根离子遇到酚酞会显示红色,所以C正确;D、原电池形成后没有气体生成,所以B中导气管不会产生气泡,所以D错误;所以选D.


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.物质发生化学变化不一定都伴随着能量变化
B.任何反应中的能量变化都表现为热量变化
C.伴有能量变化的物质变化都是化学变化
D.即使没有物质的变化,也可能有能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
(1)已知:N2(g)+2H2(g)=N2H4(l)△H=+50.6kJmol﹣12H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJmol﹣1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=kJmol﹣1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 .
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 .
(2)采矿废液中的CN﹣ 可用H2O2处理.已知:H2SO4=H++HSO4﹣ HSO4﹣H++SO42﹣用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82﹣ , S2O82﹣水解可以得到H2O2 . 写出阳极上的电极反应式 .
(3)氧化镁处理含NH4+的废水会发生如下反应: MgO+H2OMg(OH)2 Mg(OH)2+2NH4+Mg2++2NH3H2O.
①温度对氮处理率的影响如图所示.在25℃前,升高
温度氮去除率增大的原因是 .
②剩余的氧化镁,不会对废水形成二次污染,理由是 .
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下: ①取10mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175mL
②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热
③用25mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]
④将吸收液移至锥形瓶中,加入2滴指示剂,用c molL﹣1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL.
则水样中氮的含量是mgL﹣1(用含c、V的表达式表示).(请写出计算过程)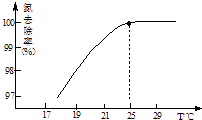
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
(1)已知:N2(g)+2H2(g)=N2H4(l)△H=+50.6kJmol﹣12H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJmol﹣1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=kJmol﹣1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 .
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 .
(2)采矿废液中的CN﹣ 可用H2O2处理.已知:H2SO4=H++HSO4﹣ HSO4﹣H++SO42﹣用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82﹣ , S2O82﹣水解可以得到H2O2 . 写出阳极上的电极反应式 .
(3)氧化镁处理含NH4+的废水会发生如下反应: MgO+H2OMg(OH)2 Mg(OH)2+2NH4+Mg2++2NH3H2O.
①温度对氮处理率的影响如图所示.在25℃前,升高
温度氮去除率增大的原因是 .
②剩余的氧化镁,不会对废水形成二次污染,理由是 .
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下: ①取10mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175mL
②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热
③用25mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]
④将吸收液移至锥形瓶中,加入2滴指示剂,用c molL﹣1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL.
则水样中氮的含量是mgL﹣1(用含c、V的表达式表示).(请写出计算过程)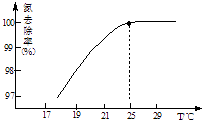
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题: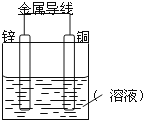
(1)若电解质溶液为稀硫酸,
①Zn棒为原电池的极,其电极反应式为 .
②Cu棒为原电池的极,其电极反应式为 .
(2)若电解质为硫酸铜溶液,
①Cu棒上发生反应,其电极反应式为 .
②若在上述两个过程中,转移电子数相等,则Cu棒上(1)和(2)所析出物质的质量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】木炭屑与浓HNO3共热,产生的气体等分为①和②两份,将第一份气体先导入适量蒸馏水中再导入石灰水中,将第二份气体直接导入石灰水中,则石灰水的变化可能是( )
A. ①不变浑浊②变乳白色B. ①变乳白色②不变浑浊
C. ①变乳白色②变乳白色D. ①不变浑浊②变浅黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.同一原子中,1s、2s、3s电子的能量逐渐减小
B.同一原子中,2p、3p、4p能级的轨道数依次增多
C.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
D.各能层含有的能级数为n(n为能层序数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2 mol·L-1的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A. 950 mL,111.2 g B. 500 mL,117.0 g
C. 1 000 mL,117.0 g D. 任意规格,111.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是( )
A.蒸馏、蒸发、分液、过滤
B.蒸馏、过滤、分液、蒸发
C.分液、过滤、蒸馏、蒸发
D.过滤、蒸发、分液、蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com