
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
| 体系中各物质 | CO | H2 | CH3OH |
| 物质的量浓度(mol/L) | 0.1 | 0.2 | 0.4 |
| C(CH3OH) |
| C(CO)?C2(H2) |
| 0.4 |
| 0.1×0.22 |


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ④ |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
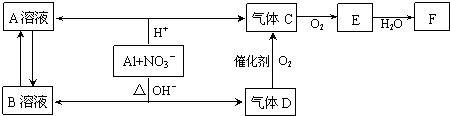
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
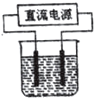 以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内气体颜色变深,平均相对分子质量不变 |
| B、平衡不移动,混合气体密度增大 |
| C、H2转化率增大,HI平衡浓度变小 |
D、 改变条件前后,速率图象为(如图) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com