
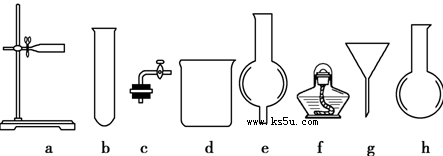


科目:高中化学 来源:不详 题型:填空题
 N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
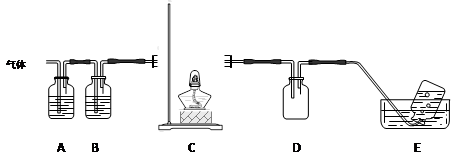
查看答案和解析>>
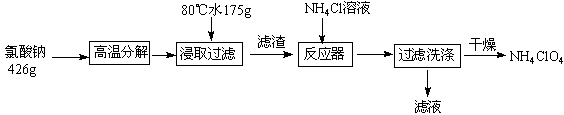
科目:高中化学 来源:不详 题型:填空题
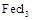 易升华。工业上制备无水的
易升华。工业上制备无水的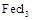 的一种工艺如图所示:
的一种工艺如图所示: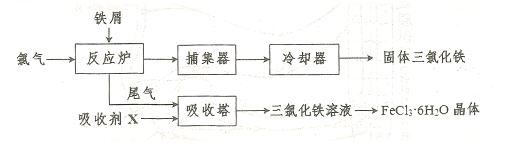
 Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。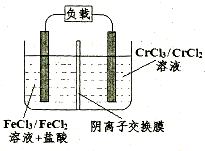
查看答案和解析>>
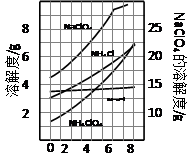
科目:高中化学 来源:不详 题型:实验题
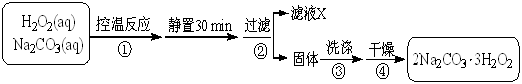
 2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
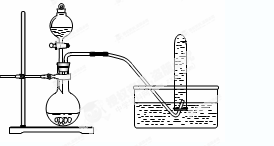
| A.铜与浓硝酸反应制NO2:可采用下图装置 |
| B.分离乙酸和乙醇溶液:用分液漏斗进行分离 |
| C.稀硫酸和锌粒反应制取氢气:加入少许硫酸铜以加快反应速率 |
| D.鉴别Na2CO3溶液和NaHCO3溶液:分别向两种溶液滴加澄清石灰水至过量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

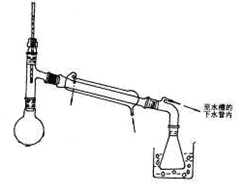
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
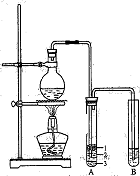
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com