
| 水蒸气浓度变化量 |
| 水蒸气的起始浓度 |
| C(CO 2)C(H 2) |
| C(CO)C(H 2O) |
 CO2+H2,
CO2+H2,| 1.2mol/L |
| 3mol/L |
 CO2+H2,
CO2+H2,| 1.2mol/L×1.2mol/L |
| 0.8mol/L×1.8mol/L |
 CO2+H2,
CO2+H2,| y×y |
| (2-y)×(6-y) |
| 1.5mol/L |
| 6mol/L |


科目:高中化学 来源: 题型:
| A、150mL1mol?L-1的NaCl |
| B、75mL2mol?L-1的NH4Cl |
| C、150mL3mol?L-1的KCl |
| D、75mL2mol?L-1的CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是纯化学变化 |
| B、是纯物理变化 |
| C、既是物理变化又是化学变化 |
| D、不能确定是化学变化还是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、移去部分SO3 |
| B、降低体系温度 |
| C、通入大量O2 |
| D、通入大量SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
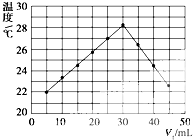 将V1 mL 1.00mol?L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1 mL 1.00mol?L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A、做该实验时环境温度为22℃ |
| B、该实验表明所有化学反应化学能只转化为热能 |
| C、NaOH溶液的浓度为1.50 mol?L-1 |
| D、该实验表明有水生成的反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
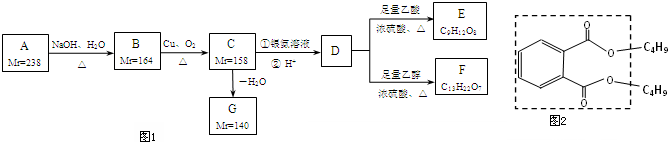
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com