
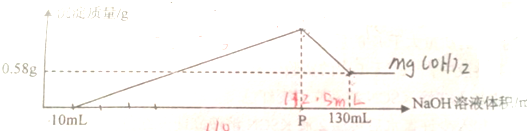
| A、盐酸的物质的量浓度为0.22mol/L |
| B、混合物中Al2O3的物质的量为0.01mol |
| C、混合物中MgO的物质的量为0.01mol |
| D、P点加入NaOH溶液的体积是110mL |
| 0.58g |
| 58g/mol |
| 1 |
| 4 |
| n |
| c |
| n |
| V |
| 0.58g |
| 58g/mol |
| 1 |
| 4 |
| 0.55mol |
| 0.25L |
| 0.05mol |
| 0.5mol/L |


科目:高中化学 来源: 题型:
| A、反应中NF3是氧化剂,H2O是还原剂 |
| B、反应中被氧化与被还原的原子物质的量之比为2:1 |
| C、若反应中生成0.2 mol HNO3,则反应共转移0.2 mol e- |
| D、NF3在潮湿空气中泄漏会产生白雾、红棕色气体等现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
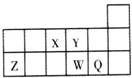
| A、原子半径Y<Z<W |
| B、元素Y的最高正化合价比元素X的最高正化合价高 |
| C、元素W的最高价氧化物对应的水化物的酸性比Q的弱 |
| D、元素X的气态氢化物的稳定性大于元素Y的气态氢化物的稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
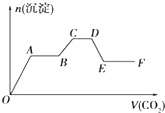 将CO2 气体缓缓通入到含有等物质的量的KOH、Ba(OH)2 和KAlO2 的混合溶液中,直至过量,生成的沉淀的物质的量与所通CO2 的体积关系如图所示(假设每步反应均完全).下列关于整个反应进程中的各种描述不正确的是( )
将CO2 气体缓缓通入到含有等物质的量的KOH、Ba(OH)2 和KAlO2 的混合溶液中,直至过量,生成的沉淀的物质的量与所通CO2 的体积关系如图所示(假设每步反应均完全).下列关于整个反应进程中的各种描述不正确的是( )| A、A→B段与C→D段所发生的反应相同 |
| B、B→C段反应的离子方程式是:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32- |
| C、O→A段反应的化学方程式是:Ba(OH)2+CO2=BaCO3↓+H2O |
| D、D→E段沉淀的减少是由于碳酸钡固体的消失所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,NA个水分子所占的体积约为22.4L |
| B、5.6g铁与氯气完全反应,失去电子的数目为0.2NA |
| C、足量Na与1molC12完全反应,转移的电子数为2NA |
| D、22.4L由N2、N2O组成的混合气体中所含有的氮原子的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
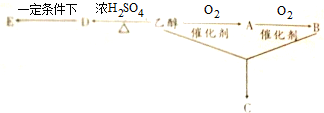
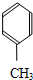 +CO
+CO| AlCl3、HCl |
| 加热 |
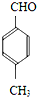
| CH3CHO |
| OH-、加热 |
| ①C |
| ②H+ |
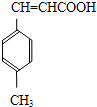
| CH3OH |
| H2SO4,加热 |
| OH-、加热 |
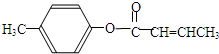 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
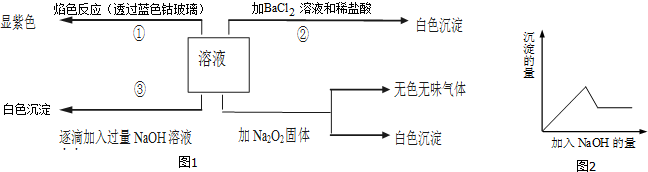
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 向AgCl沉淀中滴加KI溶液 | 沉淀变为黄色 | Ksp(AgCl)>Ksp(AgI) |
| B | 将SO2通入滴有酚酞的 NaOH溶液中 | 溶液红色褪去 | SO2具有漂白性 |
| C | 常温下铜片插入浓硫酸中 | 无明显现象 | 常温下铜遇浓硫酸钝化 |
| D | 向某溶液中加入过量盐酸 | 产生能使澄清石灰水变浑浊的无色气体 | 该溶液中一定含有CO32- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com