
| A. | Al Cr2O3 | B. | Al2O3 Fe | C. | Al MgO | D. | Al CO2 |
分析 铝热剂为铝和金属氧化物的混合物,反应在高温条件下发生氧化还原反应置换出金属单质,为放热反应,组成铝热剂成分为金属氧化物中的金属活泼性小于铝;
解答 解:A.Al和Cr2O3 组成的混合物中铝活泼性大于铬,可以组成铝热剂,故A正确;
B.Al2O3 和 Fe组成的混合物中铁活泼性小于铝,不能组成铝热剂,故B错误;
C.Al和MgO组成的混合物中镁活泼性大于铝,不能发生反应,不能组成铝热剂,故C错误;
D.Al和CO2 不能发生铝热反应,不能组成铝热剂,故D错误;
故选A.
点评 本题考查了物质分类、物质组成,主要是铝热剂组成和铝热反应实质的理解应用,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题
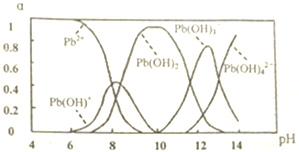
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
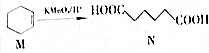 .下列说法错误的是( )
.下列说法错误的是( )| A. | M的分子式为C6H10 | |
| B. | M中所有碳原子在同一平面上 | |
| C. | N能发生氧化反应和取代反应 | |
| D. | N的含有相同官能团的同分异构体有8种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
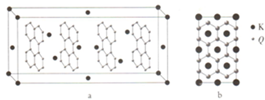
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡C一CH2CH3 丁炔 | B. | CH2=CH-CH=CH-CH3 1,3-二戊烯 | ||
| C. | 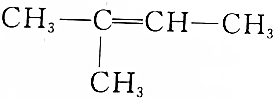 2-甲基丁烯 | D. | 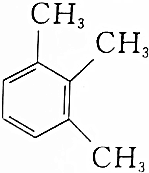 1,2,3-三甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
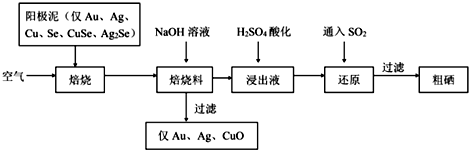
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:l | C. | 1:2 | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com