
| A. | pH=2的盐酸溶液稀释100倍,pH=0 | |
| B. | pH=12的氢氧化钠溶液稀释10倍,pH=13 | |
| C. | pH=5的硫酸溶液稀释1000倍,pH=8 | |
| D. | pH=3的盐酸溶液稀释10倍,pH=4 |
分析 A.稀释过程中氢离子浓度减小,溶液的pH增大;
B.pH=12的氢氧化钠溶液稀释10倍,氢氧根离子浓度减小,溶液的pH减小;
C.酸溶液稀释后不可能变为碱溶液,溶液的只能无限接近7;
D.pH=3的盐酸溶液稀释10倍,溶液的pH增大1个单位.
解答 解:A.pH=2的盐酸中氢离子浓度为0.01mol/L,稀释100倍后氢离子浓度为0.0001mol/L,溶液的pH=4,故A错误;
B.pH=12的氢氧化钠溶液中氢氧根离子浓度为0.01mol/L,稀释10倍后氢氧根离子浓度为0.001mol/L,溶液的pH=11,故B错误;
C.pH=5的硫酸溶液稀释1000倍,稀释后溶液仍然为酸性,溶液的pH<7,故C错误;
D.pH=3的盐酸溶液中氢离子浓度为0.001mol/L,稀释10倍后氢离子浓度为0.0001mol/L,溶液的pH=4,故D正确;
故选D.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,C为易错点,注意酸溶液稀释后不会呈碱性,试题有利于提高学生的分析能力及化学计算能力.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
| B | 物质的量之比为2:3的稀硝酸和稀硫酸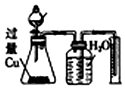 | 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
| C | 向1mL浓度均为0.05mol•L-1NaCl、NaI的混合溶液中滴加2滴0.01mol•L-1 AgNO3溶液,振荡,沉淀是黄色 | Ksp(AgCl)<Ksp(AgI) |
| D | 室温下,用pH试纸测得0.1mol•L-1NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融状态下或在水溶液中能自身电离出自由移动的离子的化合物是电解质 | |
| B. | 凡是在水溶液里和熔化状态下都不能导电的物质叫非电解质 | |
| C. | 能导电的物质一定是电解质 | |
| D. | 某物质若不是电解质,就一定是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH溶液与NaOH溶液混合 | B. | Al与Fe2O3高温下的铝热反应 | ||
| C. | KMnO4分解制氧气 | D. | Na2CO3在溶液中的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:10 | B. | 10:1 | C. | 9:2 | D. | 2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 实验目的或结论 |
| A | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性:H2O2比Fe3+强 |
| B | 向1mL 1%的NaOH溶液中加入2mL 2%的CuSO4溶液,振荡,再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | 说明Y中不含醛基 |
| C | 取a g铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为V L(已转化为标准状况下) | 测定铝箔中氧化铝的含量 |
| D | 比较不同反应的反应热数据大小 | 从而判断反应速率的大小 |
| A. | A | B. | B | ||
| C. | C D.D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O | |
| B. | NaCl(s)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑ | |
| C. | 2FeO+4H2SO4(浓)═Fe2(SO4)3+SO2↑+4H2O | |
| D. | C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com