
| A. | 原溶液中不含HCO3-和CO32- | |
| B. | 向加盐酸后的溶液中再加KSCN溶液,显红色 | |
| C. | 能确定原溶液中的五种离子 | |
| D. | 原溶液中有三种阳离子和两种阴离子 |
分析 若向原溶液中加入足量的盐酸,有气体生成;经分析知:反应后的溶液中的阴离子的种类没有变化,则原溶液中含有Cl-,一定没有HCO3-和CO32-;有气体生成则含有Fe2+和NO3-;
一共有五种离子,浓度均为0.1mol/L,Fe2+、Cl-、NO3-正好电荷守恒.说明存在的另外两种离子的带电量是一样的,则为Mg2+和SO42-,
综上可知,溶液中存在的五种离子为:Fe2+、Cl-、NO3-、Mg2+和SO42-,结合选项分析.
解答 解:向原溶液中加入足量的盐酸,有气体生成;经分析知:反应后的溶液中的阴离子的种类没有变化,则原溶液中含有Cl-,一定没有HCO3-和CO32-;有气体生成则含有Fe2+和NO3-;
一共有五种离子,浓度均为0.1mol/L,Fe2+、Cl-、NO3-正好电荷守恒.说明存在的另外两种离子的带电量是一样的,则为Mg2+和SO42-,
综上可知,溶液中存在的五种离子为:Fe2+、Cl-、NO3-、Mg2+和SO42-,
A.由以上分析可知,原溶液中一定不含有HCO3-和CO32-,故A正确;
B.若向原溶液中加入过量的稀硫酸和KSCN溶液,Fe2+与NO3-、H+反应生成Fe3+,溶液显血红色,故B正确;
C.原溶液中含有的离子为:Fe2+、Cl-、NO3-、Mg2+和SO42-,能够确定存在的离子,故C正确;
D.根据分析可知,原溶液中含有的离子为Fe2+、Cl-、NO3-、Mg2+和SO42-,含有3种阴离子、2种阳离子,故D错误;
故选D.
点评 本题考查了离子反应、离子检验方法和离子性质的分析判断,题目难度中等,反应现象的判断是解题的依据,注意干扰离子的分析判断,试题培养了学生的灵活应用能力.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用可见光束照射以区别溶液和胶体 | |
| B. | 用萃取分液的方法出去酒精中的水 | |
| C. | 通过盛有酸性高锰酸钾的洗气瓶除去甲烷中的乙烯 | |
| D. | 只滴加氨水鉴别NaCl MgCl2 AlCl3 Na2SO4 四种无色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒压下充入稀有气体 | B. | 减小反应容器的体积 | ||
| C. | 升高反应温度 | D. | 分离出生成物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水与氨水中微粒种类 | B. | 乙烷与苯分子中碳碳键键长 | ||
| C. | 氯化铯与氯化钠的熔点 | D. | Al2O3与AlCl3的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
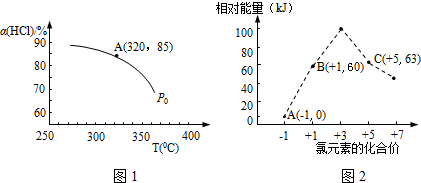
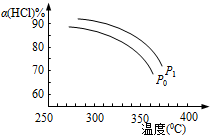 ,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的摩尔质量28g/mol | |
| B. | 1molCO中所含分子数为6.02×1023个 | |
| C. | 1mol CO的质量是28g | |
| D. | 常温常压下,1mol CO的体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中所含离子的种类相同 | B. | 溶液的pH相同 | ||
| C. | 都能与盐酸反应放出CO2气体 | D. | 都能使澄清石灰水变浑浊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com