
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
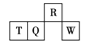
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 含T的盐中,T元素只能存在于阳离子中
科目:高中化学 来源: 题型:
【题目】环境和资源是人类面临的两大课题,下列说法正确的是( )
A. 燃煤中加入生石灰既可减少酸雨的产生,又可减少温室气体的排放
B. 石油分馏所得的汽油、煤油等产品均属于化合物
C. 海水淡化后所得的盐卤可提取溴、镁等多种重要元素
D. 沼气的主要成分为CH4,属于不可再生资源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比是( ).
A.11∶1 B.9∶1 C.1∶11 D.1∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示。
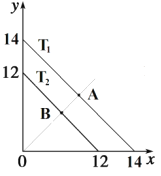
①若从A点到B点,可采取的措施为_________。
②T2 ℃时,将pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,则水电离出的c(OH-)将______(填“增大”、“减小”、“不变”)。
③已知:T1 ℃时, 醋酸的电离常数为 1.8×10-5,则 T1 ℃时, 在 0.5 mol·L-1的醋酸溶液中由醋酸电离出的 c(H+)约是水电离出的 c(H+)的__________ 倍。
④T2 ℃时,将某溶液(此溶液满足 lg [c(H+)/c(OH-)]=10)滴入含 Na+、 HS-、 SO42-、 K+的溶液中,发生反应的离子方程式为___________。
(2)体积均为1 mL pH=2的一元酸HA和HB,加水稀释过程中pH与溶液体积关系如图所示:
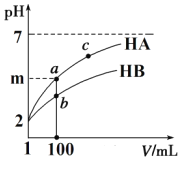
①m的取值为______________。
②a点酸的浓度____________b点酸的浓度(填 “>”、“<”、“=”)。
③若 m<4,常温下a点到c点的过程中,下列表达式的数据变大的是_____________。
A.c(A-) B. n(H+)· n(OH-) C. c(H+)/c(A-) D. c(A-)/[c(HA)· c(OH-)]
(3)已知:25 ℃时,HCN、H2CO3 的电离平衡常数分别为K=4.9×10-10,K1=4.3×10-7、K2=5.6×10-11,向NaCN溶液中通入少量CO2,所发生反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列实验方案能达到目的是( )
A. 除去NaCl固体中混有的MgCl2:加入KOH试剂后过滤
B. 实验室获取少量纯净的水:蒸馏自来水
C. 提纯混有少量硝酸钾的氯化钾:将混合物溶于热水中,再冷却、结晶并过滤
D. 提取碘水中的碘:加入适量乙醇,振荡、静置、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断正确的是

A. a气体为氢气,b气体为氧气
B. A溶液为氢氧化钠,B溶液为硫酸
C. c隔膜为阳离子交换膜、d隔膜为阴离子交换膜
D. 该电解反应的总方程式可以表示为:2Na2SO4+6H2O![]() 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案, 能达到实验目的的是( )
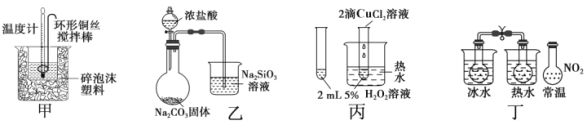
A.图甲:进行中和热的测定
B.图乙:比较 HCl、H2CO3和 H2SiO3 的酸性强弱
C.图丙:验证 CuCl2对 H2O2 分解有催化作用
D.图丁:验证 2NO2(g)![]() N2O4 (g) △H<0
N2O4 (g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度ρg/ml,质量分数为W,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A.ρ=(17V+22400)/(22.4+22.4V) B.W=17c/(1000ρ)
C.W=17V/(17V+22400) D.C=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx会引起光化学烟雾等环境问题,在催化剂存在条件下,以NH3或尿素将尾气中NOx
还原为N2的技术,即NH3或尿素-SCR技术,是去除NOx最为有效且应用最广的技术之一,其中最重要的催化剂体系是钒基催化剂。
(1)NH3去除尾气中的NOx,当v(NO):v(NO2)=l:1时称为“快速SCR 反应”,该反应化学方程式为___________。
(2)不同钒含量的催化剂(V2O5/TiO2)添加WO3对NO去除率的影响如下图,从图中可以得出其它条件相同时添加WO3,对NO去除率的影响是_____(填“增大”、“减小”或“无影响”)。根据图中所示,随着温度升高NO去除率的变化趋势为_____,该变化趋势的一种可能原因是___________。

(3)在制备钒基催化剂时,添加的各种成型助剂中碱金属或碱土金属(如Na、K、Ca)能够使催化剂中毒(催化性能下降), K、Ca的毒化作用与Na相似。下列适合做成型助剂有_____。
A.Li B.Mg C.酸性铝溶胶 D.酸性硅溶胶
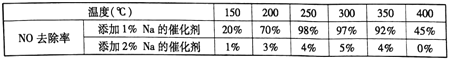
请设计实验研究添加金属K对催化剂活性的影响(只需写出实验思路,不需要具体实验
操作)_____________。
(4)在NOx催化去除过程中,NH3储罐存在危险性,更多应用为尿素-SCR技术。在该技术过程中,发生如下两个反应:
① CO(NH2)2=NH3+HNCO
② HNCO(g)+H20(g)====NH3(g)+CO2(g)
在此过程中一分子尿素可以生成两分子NH3,因此尿素被视为是NH3的有效储存源。反应②的平衡常数表达式为_______。目前商用的尿素溶液浓度为32.5%(密度为1.05g/mL),常称为“Ad Blue ”。1L该商用尿素溶液发生“快速SCR反应”, 理论上最多可消除NO和NO2在标准状况下的体积为______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com