
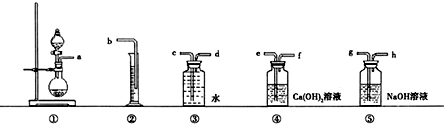
分析 过碳酸钠中一般都含有Na2CO3,为了测定它的纯度,取一定量的样品和盐酸反应,通过测量产生的氧气的体积,可以计算出过碳酸钠的含量.
(1)依据测定目的和装置特征分析滤液装置中分液漏斗滴加盐酸是样品全部反应,同诺氢氧化钠溶液吸收生成的二氧化碳气体,同诺饱和氢氧化钙溶液检验二氧化碳是否吸收完全,利用排水量气装置测定氧气的体积计算得到过碳酸钠纯度;
(2)装置④是盛饱和氢氧化钙溶液的洗气瓶,主要是检验二氧化碳是否被吸收完全,以免影响后续氧气体积的测定;
(3)计算氧气物质的量,结合化学方程式计算碳酸钠物质的量得到样品中的质量,计算得到质量分数;
(4)假设0.9g样品为纯净的过碳酸钠,此时所产生的O2的体积为最大值,约为83mL,故应选择100mL的量筒.
解答 解:过碳酸钠中一般都含有Na2CO3,为了测定它的纯度,取一定量的样品和盐酸反应,通过测量产生的氧气的体积,可以计算出过碳酸钠的含量.
(1)依据测定目的和装置特征分析滤液装置中分液漏斗滴加盐酸是样品全部反应,同诺氢氧化钠溶液吸收生成的二氧化碳气体,同诺饱和氢氧化钙溶液检验二氧化碳是否吸收完全,利用排水量气装置测定氧气的体积计算得到过碳酸钠纯度,组装一套测定商品过碳酸钠的实验装置,这些装置的连接顺序是aghefdcb,
故答案为:aghefdcb;
(2)装置④是盛饱和氢氧化钙溶液的洗气瓶,主要是检验二氧化碳是否被吸收完全,以免影响后续氧气体积的测定;
故答案为:检验CO2是否完全被吸收;
(3)设过碳酸钠的物质的量为n,则
2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O;
2 1
n $\frac{V×1{0}^{-3}L}{22.4L/mol}$
n=$\frac{V×1{0}^{-3}}{22.4}×2$mol
样品的纯度=$\frac{\frac{v×1{0}^{-3}}{22.4}×2×122}{W}$×100%,
故答案为:$\frac{\frac{v×1{0}^{-3}}{22.4}×2×122}{W}$×100%;
(4)假设0.9g样品为纯净的过碳酸钠,此时所产生的O2的体积为最大值,约为83mL,故应选择100mL的量筒,
故答案为:100mL.
点评 本题考查了物质存在的分析实验探究方法和纯度测定方法恒容计算,掌握装置特征和实验过程分析判断,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
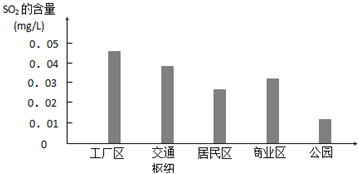
| A. | ⑤<④<③<①<② | B. | ②<①<③<④<⑤ | C. | ⑤<④<②=③<① | D. | ⑤<③<④<②<① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质一定是钠的化合物 | B. | 该物质一定含钠元素 | ||
| C. | 该物质一定是单质钠 | D. | 能确定是否含钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水,阳极的电极反应式为2Cl--2e-═Cl2↑ | |
| B. | 外加电流的金属保护中,被保护的金属与电源的正极相连,发生氧化反应 | |
| C. | 粗铜精炼时,与电池正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在钠、钾、铷三种单质中,钠的熔点最高 | |
| B. | 所有碱金属均为银白色 | |
| C. | 同一主族卤素单质从上到下熔沸点依次升高 | |
| D. | 液溴易挥发,可以通过水封的方式进行保存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com