
【题目】在同一温度下,某强电解质溶液a,弱电解质溶液b,金属导体c的导电能力相同,则升高温度后它们的导电能力:( )
A.a>b>cB.a=b=cC.c>a>bD.b>a>c
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】用石墨电极电解CuSO4溶液一段时间后,向所得溶液中加入0.1molCu(OH)2后,恰好使溶液恢复到电解前的浓度。则电解过程中转移的电子的物质的量为
A.0.4molB.0.5molC.0.6molD.0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.纳米级Cu2O既是航母舰艇底部的防腐蚀涂料,也是优良的催化剂。
(1)已知:C(s)+![]() O2(g)=CO(g)ΔH =–110.4kJmol-1,
O2(g)=CO(g)ΔH =–110.4kJmol-1,

2Cu2O(s)+O2(g)= 4CuO(s) ΔH =–292kJmol-1,则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为________。
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢制取甲醛:
CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
①该反应的ΔH___0 (填“>”或“<”);600K时,Y点甲醇的v(正) ____v(逆)(填“>”或“<”)。
②从Y点到X点可采取的措施是___________________________________。
③在t1K时,向固定体积为2L的密闭容器中充入1molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)=_____________, 温度为t1时,该反应的平衡常数K=____________。
Ⅱ.金属铜因导电性强而应用广泛。
由黄铜矿冶炼得到的粗铜经过电解精炼才能得到纯铜。电解时,粗铜作______极,阴极的电极反应式为_______________。
Ⅲ.含铜离子的的废水会造成污染,通常将其转化为硫化铜沉淀而除去。
已知:Ksp[CuS]=1×10-36,要使铜离子的浓度符合排放标准(不超过0.5mg/L),溶液中的硫离子的物质的量浓度至少为__________mol/L(保留至小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述正确的是( )
H++CH3COO-,下列叙述正确的是( )

A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
D.0.10mol·L-1的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2O的沸点高于H2S是因为________________;H2O分子比H2S分子稳定是因为__________________。
(2)Al和铁红发生铝热反应的化学方程式_________________,该反应的用途是_________________(任写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关.
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
时间 | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标况) | 100 | 240 | 464 | 576 | 620 |
①哪一段时间内反应速率最大:____min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。
②3~4min内以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积.他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量.你认为不可行的是____(填字母)。
A 蒸馏水 B KCl洛液 C 浓盐酸 D CuSO4溶液
(3)在4L密闭容器中,X、Y、Z三种气体的物质的量随时间变化曲线如图。

①该反应的化学方程式是_______________。
②该反应达到平衡状态的标志是___________(填字母)。
A Y的体积分数在混合气体中保持不变 B X,、Y的反应速率比为3:1
C 容器内气体压强保持不变 D 容器内气体的总质量保持不变
E 生成1molY的同时消耗2molZ
③2min内Y的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
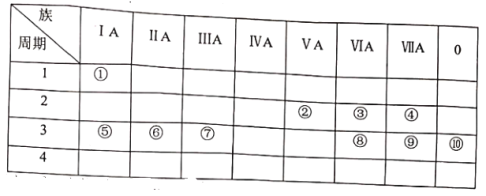
试用合适的化学用语回答下列问题:
(1)请画出元素④简单阴离子的结构示意图:____________。
(2) ③⑤⑧的原子半径由小到大的顺序为__________(填元素符号)。
(3)⑧和⑨的最高价氧化物对应水化物的酸性强弱为_____ > _____(填化学式)。
(4) ③⑤两种元素的原子按1:1组成的常见化合物的电子式 为_______。
(5)写出⑦的单质与⑤的最高价氧化物对应水化物溶液反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如下图所示。
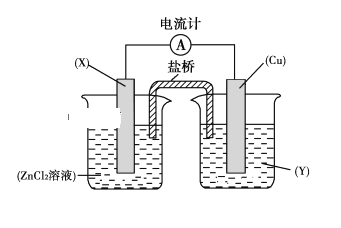
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________。
(2)铜电极为电池的________极,发生的电极反应为______________________,X极上发生的电极反应为________________。
(3)外电路中的电子是从________极流向________极。
(4)盐桥中的Cl-向________极移动,如将盐桥撤掉,电流计的指针将________偏转。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,它们之间有如下转化关系:
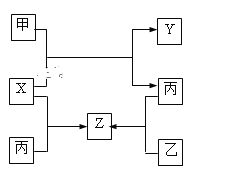
⑴若甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体, 试推断:
①X的电子式是______________________________。
②X与甲反应的化学方程式______________________________________________。
⑵若甲是气体单质,丙通常是液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子,试推断:
①写出Z的化学式_______________________。
②写出X与足量的甲在溶液中完全反应的离子方程式:_________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com