

分析 氟碳铈矿主要化学成分为CeFCO3,用硫酸强化焙烧得浸出液中含有,氟离子、铈离子、硫酸等,尾气中主要含有二氧化碳,加入碳酸钙会生成硫酸钙和氟化钙等难溶物为滤渣,和硫酸稀土溶液,在硫酸稀土溶液中加入萃取剂HT,经过分液将溶液中的Ce3+萃取出来,再加入稀硫酸得含有Ce3+的溶液,调节溶液的pH值得Ce(OH)3沉淀,再经过氧气氧化,过滤、洗涤、干燥可得Ce(OH)4产品,
(1)根据影响反应速率的因素可知,为增大反应速率,提高原料的利用率,焙烧前可将矿石粉碎成细颗粒处理;
(2)氟碳铈矿用硫酸强化焙烧得滤液中含有氟离子、铈离子、硫酸等,加入碳酸钙会生成硫酸钙和氟化钙等难溶物,据此答题;
(3)操作II为分液,分液需要的主要玻璃仪器有分液漏斗、烧杯、玻璃棒等;萃取的目的是将溶液中的Ce3+萃取出来,根据萃取剂的要求选择;
(4)根据平衡2Ce3+ (水层)+6HT(有机层)?2CeT3(有机层)+6H+(水层)可知,加入酸平衡向逆反应方程移动,据此分析;
(5)根据溶度积=c3(OH-)•c(Ce3+),结合pH=8及c(Ce3+)=b mol•L-1,可计算出a和b的关系;
(6)根据流程结合元素守恒可知Ce(OH)3结合氧气和水生成Ce(OH)4,据此书写化学方程式;
(7)根据电子得失守恒有关系式Ce(OH)4~FeSO4,根据FeSO4标准溶液中FeSO4的物质的量可计算出Ce(OH)4的质量,进而确定Ce(OH)4的质量分数.
解答 解:(1)根据影响反应速率的因素可知,为增大反应速率,提高原料的利用率,焙烧前可将矿石粉碎成细颗粒处理,
故答案为:粉碎成细颗粒;
(2)氟碳铈矿用硫酸强化焙烧得滤液中含有氟离子、铈离子、硫酸等,加入碳酸钙会生成硫酸钙和氟化钙等难溶物,所以操作I中滤渣的主要成分是CaF2、CaSO4,
故答案为:CaF2、CaSO4;
(3)操作II为分液,分液需要的主要玻璃仪器有分液漏斗、烧杯、玻璃棒等;萃取的目的是将溶液中的Ce3+萃取出来,根据萃取剂的要求选择可知,HT要不溶于水,也不和水反应、Ce3+不和萃取剂HT发生反应、Ce3+在萃取剂HT中溶解度大于水,故选①②③,
故答案为:分液漏斗;①②③;
(4)根据平衡2Ce3+ (水层)+6HT(有机层)?2CeT3(有机层)+6H+(水层)可知,混合液中加入H2SO4使c(H+)增大,平衡向形成Ge3+水溶液方向移动,
故答案为:混合液中加入H2SO4使c(H+)增大,平衡向形成Ge3+水溶液方向移动;
(5)根据题意,溶液中c(OH-)=10-6 mol•L-1,根据溶度积=c3(OH-)•c(Ce3+)可知a=(10-6)3•b,所以a=10-18b,
故答案为:a=10-18b;
(6)根据流程结合元素守恒可知Ce(OH)3结合氧气和水生成Ce(OH)4,反应的化学方程式为4Ce(OH)3+O2+2H2O=4Ce(OH)4,
故答案为:4Ce(OH)3+O2+2H2O=4Ce(OH)4;
(7)根据电子得失守恒有关系式Ce(OH)4~FeSO4,FeSO4标准溶液中FeSO4的物质的量为0.025×0.1mol=0.0025mol,所以Ce(OH)4的质量为0.0025mol×208g/mol=0.52g,则样品中Ce(OH)4的质量分数为$\frac{0.52}{0.545}$×100%=95%,
故答案为:95%.
点评 本题主要考查了影响化学反应速率的因素、物质的分离子操作、化学平衡的移动、氧化还原反应的书写及质量分数的计算,是对化学基础知识的综合考查,对学生综合应用基础知识的能力要求较高,答题时注意守恒的方法及平衡的思想的运用,题目难度中等.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
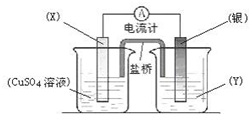 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
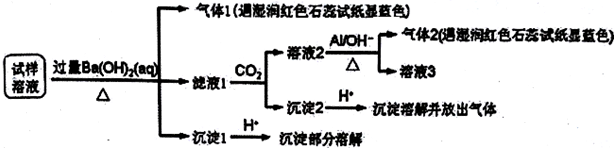
| A. | 试样中肯定存在NH4+、Mg2+、SO42-和NO3- | |
| B. | 该雾霾中可能存在NaNO3、NH4Cl和MgSO4 | |
| C. | 试样中可能存在Na+、Cl- | |
| D. | 试样中一定不含Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:
依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 回收各种废弃塑料 | B. | 将用过的塑料袋立即焚烧 | ||
| C. | 使用可降解塑料 | D. | 用布购物袋替代一次性塑料购物袋 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com