
【题目】硫—碘循环分解水制氢主要涉及下列反应:
① SO2+2H2O+I2===H2SO4+2HI ② 2HI![]() H2+I2 ③ 2H2SO4 === 2SO2+O2+2H2O
H2+I2 ③ 2H2SO4 === 2SO2+O2+2H2O
(1)整个过程中SO2、I2的作用是______。
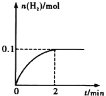
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应②,已知H2的物质的量随时间的变化如图所示,则在0~2 min内的平均反应速率v (HI) =______;
(3)已知拆开1 mol H—I键需要消耗298kJ能量,形成1mol H—H键能够释放436kJ能量,形成1mol I—I键能够释放151kJ能量,则在反应②中,分解0.2mol HI时会______(填“吸收”或“释放”)______kJ能量。
(4)实验室用Zn和硫酸制H2,为了加快反应速率下列措施不可行的是__(填序号)
a.加入浓硝酸 b.加入少量CuSO4 固体 c.用粗锌代替纯锌 d.加热 e.把锌粒弄成锌粉 f.用98.3%的浓硫酸
(5)氢气可用于制燃料电池,某种氢氧燃料电池是用固体金属化合物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-== 2H2O ,B极:O2+4e-== 2O2-,则A极是电池的___极;电子从该极___(填“流入”或“流出”)。
【答案】催化作用(或催化剂或加快反应速率) 0.1mol/(L·min) 吸收 0.9 a、f 负极 流出
【解析】
(1)由题干提供的反应过程看出,SO2、I2参加了反应但没有消耗,所以整个过程中SO2、I2的作用是催化剂;
故答案为:催化剂;
(2)由图示知2min内,氢气的物质的量由0变为0.1mol,v(H2)=c(H2)/t=![]() =0.05mol/(Lmin),由方程式2HI H2+I2得v(HI)= 2v(H2)= 0.05mol/(Lmin)×2=0.1mol/(Lmin);
=0.05mol/(Lmin),由方程式2HI H2+I2得v(HI)= 2v(H2)= 0.05mol/(Lmin)×2=0.1mol/(Lmin);
故答案为:0.1mol/(Lmin);
(3)由方程式2HI H2+I2得,分解0.2mol的HI时,断开化学键吸收的能量为:298kJ×0.2=59.6kJ,形成化学键释放的能量为:436kJ×0.1+151kJ×0.1=58.7 kJ,吸收的能量大于释放的能量,所以该反应吸收能量,大小为59.6kJ-58.7kJ=0.9 kJ;
故答案为:吸收,0.9;
(4)a.浓硝酸属于强氧化性酸,与锌反应不生成氢气,故a不可行;
b.加入少量CuSO4 固体,锌置换出铜,构成了原电池,反应加快,故b可行;
c.用粗锌代替纯锌,杂质与锌构成了原电池的两极,形成原电池,反应加快,故c可行;
d.温度升高,反应加快,故d可行;
e.把锌粒弄成锌粉,增大了接触面积,反应加快,故e可行;
f.98.3%的浓硫酸具有强氧化性,与锌反应不生成氢气,故f不可行;
故答案为:a、f;
(5)由电极反应得,A极失去电子,是电池的负极;电子从负极流出;
故答案为:负极;流出。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】室温下,在一定量0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列说法不正确的是( )

A. a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
B. Ksp[Al(OH3)]=10-32
C. c~d段,溶液中离子浓度的关系为:c(Na+)+ c(H+)+ 3c(Al3+)= c(OH-)+c(AlO2-)
D. d点时,溶液中离子浓度的大小关系为:c(Na+)>c(AlO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,Ksp(AgNO2)=2×10-8 mol2·L-2;Ksp(AgCl)=1.8×10-10 mol2·L-2。
(1)向2 mL 0.1 mol·L-1 NaNO2 溶液中滴加几滴稀硝酸银溶液,出现白色沉淀,再滴入0.5 mol·L-1 NaCl溶液,发生反应:AgNO2(s)+Cl-(aq)![]() AgCl(s)+NO2-(aq),则该反应的化学平衡常数K= 。
AgCl(s)+NO2-(aq),则该反应的化学平衡常数K= 。
(2)取物质的量浓度均为 0.1 mol·L-1 NaNO2、NaCl的混合溶液,逐滴加入AgNO3溶液(忽略体积改变)。当 AgNO2开始沉淀时,计算溶液中Cl-的物质的量浓度(写出必要的计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:
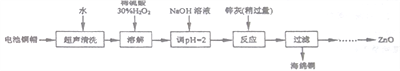
(1)①铜帽溶解时加入H2O2的目的是___________________(用化学方程式表示)。
②铜帽溶解后需将溶液中过量H2O2除去。除去H2O2的简便方法是_________________。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点。上述过程中的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为_____________,滴定终点观察到的现象为_________________。
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会__________(填“偏高”“ 偏低”“ 不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Fe 2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0mol·L-1HNO3、1.0mol·L-1NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为:
①向滤液中加入___________使其充分反应;②滴加1.0mol·L-1的氢氧化钠,调节3.2≤pH<5.9,使___________沉淀完全;③过滤;④向滤液中滴加1.0 mol·L-1的氢氧化钠,调节pH为________≤pH≤_______,使Zn2+沉淀完全,⑤过滤、洗涤、干燥;⑥900℃煅烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池可以使用在航天飞机上,其反应原理如图所示。下列有关氢氧燃料电池的说法中不正确的是
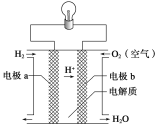
A. 该电池中电极a是正极
B. 外电路中电子由电极b通过导线流向电极a
C. 该电池的正极反应为O2+4H++4e- = 2H2O
D. 该电池的总反应:2H2+O2 = 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为:N2O(g)+CO(g)![]() CO2(g)+N2(g)ΔH,有关化学反应的物质变化过程如图1,能量变化过程如图2。下列说法正确的是
CO2(g)+N2(g)ΔH,有关化学反应的物质变化过程如图1,能量变化过程如图2。下列说法正确的是
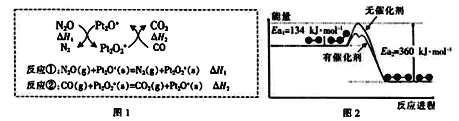
A. 由图1可知:ΔH1=ΔH+ΔH2
B. 由图2可知:ΔH=-226kJ/mol
C. 由图2可知:反应①的反应速率比反应②快
D. 为了实现转化需不断向反应器中补充Pt2O+和Pt2O2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素基态原子的价层电子排布式为_____________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Y的曲线是_________(填标号)。
[Failed to download image : http://192.168.0.10:8086/QBM/2018/6/1/1957930255540224/1961602752167936/STEM/676db9e64b15468faa67ccb9aa300976.png]
(3)化合物(XH2=X=O)分子中X原子杂化轨道类型分别是_____________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为________________。
(5)某R的氧化物立方晶胞结构如图所示,该物质的化学式为____________。(用元素符号表示),已知该晶体密度为ρg/cm3,距离最近的原子间距离为dpm,则R的相对原子质量为____________。(阿伏加德罗常数为NA)
[Failed to download image : http://192.168.0.10:8086/QBM/2018/6/1/1957930255540224/1961602752167936/STEM/02395761f35f4972ad3c8807ad342892.png]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)按要求回答下列问题:
(1)在一定的温度和压强下,2 体积 X Y 2 (g)跟 3 体积Z2(g)化合生成 2 体积气态化合物,则该气态化合物的化学式是 _________(用X、Y、Z表示)
(2)用KMnO4氧化盐酸,其反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中,氧化剂是________。当有1mol KMnO4和一定量盐酸恰好完全反应,反应后溶液的体积为2L ,则所得溶液中Cl—的物质的量浓度为_______,被氧化的HCl的物质的量为________。
(II)现有下列物质:①H2O、②空气、③Mg、④CaCO3、⑤H3PO4、⑥CuSO4﹒5H2O、⑦浓硝酸、⑧无水酒精、⑨硫酸、⑩盐酸。
其中,属于电解质的是____________(填序号,下同);属于非电解质的是____________;属于强电解质的是____________;能导电的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag2SO4微溶于水,可溶于硝酸。溶液X中可能含有Na+、Ca2+、Fe2+、Cl-、Br-、CO![]() 、SiO
、SiO![]() 、SO
、SO![]() 中的几种离子。为了确定其组成,某同学进行了如下实验:
中的几种离子。为了确定其组成,某同学进行了如下实验:

下列说法正确的是( )
A. 溶液X中一定含有Na+、Cl-和SiO![]()
B. 溶液X中一定不含Ca2+、Br-
C. 为确定溶液X中是否含有SO![]() ,可取溶液2,加入BaCl2溶液
,可取溶液2,加入BaCl2溶液
D. 在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变成血红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com