
分析 (1)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
②4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
则反应N2(g)+3H2(g)═2NH3(g)可以是①+③×$\frac{3}{2}$-②×$\frac{1}{2}$得到,热量也进行相应的计算;
(2)平衡常数只与温度有关,催化剂不能改变平衡状态,根据影响化学平衡移动的因素以及影响化学平衡常数的因素来回答;
(3)氨水可以和盐酸之间发生反应得到氯化铵溶液,根据离子浓度大小比较方法来回答;
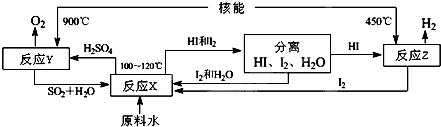
(4)根据流程图判断能循环使用的物质;根据水和氢气的关系式计算生成的氢气的量.
解答 解:(1)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
②4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
由盖斯定律可知①+③×$\frac{3}{2}$-②×$\frac{1}{2}$得到N2(g)+3H2(g)═2NH3(g),
所以该反应的△H=180.5kJ•mol-1+(-483.6kJ•mol-1)×$\frac{3}{2}$-(-905kJ•mol-1)×$\frac{1}{2}$=-92.4kJ/mol,
故答案为:△H=-92.4kJ/mol;
(2)平衡常数只与温度有关,催化剂不能改变平衡状态,增大反应物浓度化学平衡正向移动,增大压强,化学平衡向着正反应方向移动,因此能使平衡向正反应方向移动且平衡常数不变的是①②,
故答案为:①②;
(3)将相同体积、pH之和为14的氨水和盐酸混合后,所得的溶液是氯化铵和氨水的混合物,
溶液中离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(4)根据流程图知,该流程中循环使用的原料有SO2、I2;一个H2O中含有2个氢原子,所以水分子和氢分子的个数之比是1:1,故从理论上讲,该流程中,1mol原料水制得1mol氢气.
故答案为:I2;1.
点评 本题是一道综合知识的考查题,涉及热化学、化学平衡移动,无机化学流程图等方面知识,综合性较强强,难度中等,侧重于学生分析和解决问题的能力,(4)是难点,会分析流程图是解本题的关键.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ③④ | C. | ①②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸氢钠稀溶液 | B. | 硝酸钠溶液 | C. | 醋酸钠溶液 | D. | 硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com