
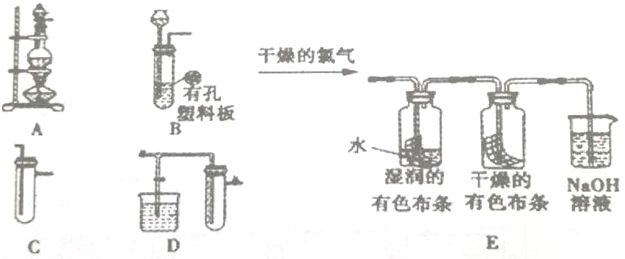
分析 (1)实验室用加热二氧化锰与浓盐酸的方法制取氯气;
(2)浓盐酸具有挥发性,制取的氯气中含有氯化氢和水蒸气,分别用饱和食盐水、浓硫酸除杂;根据实验发生装置→除杂装置→收集装置→尾气处理装置排序;
(3)氯气能够与水反应生成次氯酸,次氯酸具有漂白性,能够使有色布条褪色;
(4)氯气有毒,不能直接排放到空气中,氯气能够与碱反应,应选择碱性溶液吸收过量的氯气;
(5)根据化学方程式Cl2+2NaOH=NaCl+NaClO+H2O进行计算.
解答 解:(1)二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气和水,方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,制取的氯气中含有氯化氢和水蒸气,分别用饱和食盐水洗气瓶(C)、浓硫酸洗气瓶(C)除杂,所以正确的顺序为:ACC;
故答案为:ACC;
(3)将干燥的氯气通入后,E图集气瓶中湿润的有色布条很快褪色,而干燥的有色布条没有很快褪色,由此认为 HClO具有漂白性;为使实验更严密,应先通入干燥的有色布条,再通过湿润的有色布条;
故答案为:HClO;先通过干燥的有色布条,再通过湿润的有色布条;
(4)氯气有毒,不能直接排放到空气中,氯气能够与碱反应,可以用氢氧化钠溶液吸收氯气,氯气与氢氧化钠反应生成氯化钠和次氯酸钠、水,方程式:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:吸收过量的氯气;Cl2+2NaOH=NaCl+NaClO+H2O;
(5)5分钟时n(Cl2)=$\frac{1.12L×5}{22.4L/mol}$=0.25mol,根据反应方程式Cl2+2HaOH=NaCl+NaClO+H2O可知,
需要n(NaOH)=0.5mol,
所以V(NaOH)=$\frac{0.5mol}{2mol/L}$=0.25L=250mL,
故答案为:250.
点评 本题考查氯气的实验室制备及HClO的漂白性的探究,题目难度不大,明确氯气制备原理及性质是解题关键,注意氯气与次氯酸性质的差异性,注意相关反应化学方程式或者离子方程式的书写.


科目:高中化学 来源: 题型:选择题
| A. | 一位同学 | B. | 二位同学 | C. | 三位同学 | D. | 四位同学 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的电子式为Na:$\underset{\stackrel{•}{C}}{•}\underset{\stackrel{•}{l}}{•}$: | |
| B. | 次氯酸的电子式H:$\underset{\stackrel{•}{C}}{•}\underset{\stackrel{•}{l}}{•}$: | |
| C. | 二氧化碳的结构式为O=C=O | |
| D. | NaHCO3的电离方程式为NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
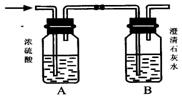 某混合气体X含H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:
某混合气体X含H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
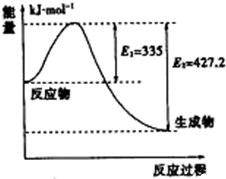 由化学能转变的热能或电能是人类使用的最主要的能源.
由化学能转变的热能或电能是人类使用的最主要的能源.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com