
【题目】把一块表面已部分被氧化为氧化钠的钠块1.08g放入20g水中,得到标准状况下氢气224mL。求:
①被氧化前钠块的质量__________________。
②所得溶液中溶质的质量分数_____________(计算结果均保留两位有效数字)
【答案】0.92g 7.6%
【解析】
(1)根据n=![]() 计算氢气的物质的量,再根据反应2Na+2H2O=2NaOH+H2↑计算样品中Na的质量,进而计算Na2O的质量,根据Na2O中元素质量分数计算含有Na的质量,单质钠与氧化钠中钠元素质量之和为被氧化前钠块的质量;
计算氢气的物质的量,再根据反应2Na+2H2O=2NaOH+H2↑计算样品中Na的质量,进而计算Na2O的质量,根据Na2O中元素质量分数计算含有Na的质量,单质钠与氧化钠中钠元素质量之和为被氧化前钠块的质量;
(2)利用n=![]() 计算钠的物质的量,再利用钠元素守恒计算生成NaOH的总物质的量,溶液质量=1.08g+20g-氢气质量,进而计算溶质质量分数分数。
计算钠的物质的量,再利用钠元素守恒计算生成NaOH的总物质的量,溶液质量=1.08g+20g-氢气质量,进而计算溶质质量分数分数。
(1)n(H2)=![]() =
=![]() =0.01mol,
=0.01mol,

m(Na)=![]() =0.46g,
=0.46g,
故m(Na2O)=1.08g-0.46g=0.62g,Na2O中Na元素的质量=0.62g×![]() =0.46g,
=0.46g,
所以被氧化前钠块的质量=0.46g+0.46g=0.92g,
故答案为:0.92g;
(2)钠原子总物质的量=![]() =0.04mol,
=0.04mol,
根据钠原子守恒,与水反应生成的n(NaOH)=n(Na)=0.04mol,
溶液质量=1.08g+20g-0.01mol×2g/mol=21.06g,
故溶液质量分数=![]() ×100%=7.6%,
×100%=7.6%,
故答案为:7.6%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下:

(1)Co2+基态核外电子排布式为________。
(2)NH2OH分子中氮原子轨道的杂化类型是_______,lmolNH2OH分子中含有σ键的数目为_______。
(3)N、H、O三种元素的电负性由小到大的顺序为_________。
(4)ClO4-的空间构型为__________。
(5)一种铁、碳形成的间隙化合物的晶体结构如右图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中,
(1) ______ 元素被氧化, ______ 是氧化剂;
(2) ______ 是氧化产物, ______ 发生氧化反应;
(3)被还原的HNO3与参加反应的HNO3物质的量之比是 ______;
(4)用双线桥标出该反应电子转移的方向和数目:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O_________________;
(5)当有8mol HNO3被还原时,反应转移___________个电子;
(6)写出该反应的离子反应方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。钠及其氧化物的物质的量 均为0.1 mol,水的质量为100 g。下列说法正确的是

A.甲、乙、丙都属于氧化还原反应
B.甲反应的离子方程式为Na+2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
C.丙充分反应,能产生0.05 mol O2,转移电子0.1 mol
D.甲、乙、丙充分反应后所得溶液的质量分数分别为w1、w2、w3,则2w1=w2=w3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,0.1 mol N2(g)与0.3 mol H2(g)在恒容密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-akJ·molˉ1(a>0)。下列说法正确的是
2NH3(g)ΔH=-akJ·molˉ1(a>0)。下列说法正确的是
A.容器内气体的压强不再发生变化,说明反应达到平衡状态
B.达到化学平衡状态时,正、逆反应速率都为零
C.相同时间内,断开H—H键的数目和生成N-H键的数目相等
D.平衡时容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g) ![]() NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
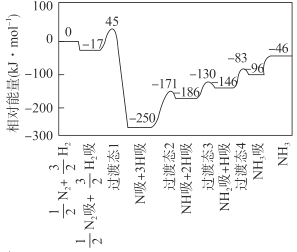
A.该反应的△H = -46 kJ·mol- 1
B.该反应机理中最大活化能为79 kJ·mol- 1
C.升高温度,该反应过渡态的能量会增大
D.该反应达到平衡后增大压强反应正向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性废液中含有Fe3+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对该废液进行处理(所加试剂均稍过量),以回收金属,保护环境。

请回答:
(1)沉淀a中含有的单质是______________________。
(2)沉淀c的化学式是__________________________。
(3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测显示,某地市的主要气体污染物为SO2、NOx、CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:![]() ΔH=241.8kJ·mol-1,
ΔH=241.8kJ·mol-1,
![]() ΔH=-110.5kJmol-1
ΔH=-110.5kJmol-1
写出焦炭与1mol水蒸气反应生成水煤气的热化学方程式:________。
(2)汽车尾气中NO是在发动机汽缸中生成的,反应为N2(g)+O2(g)![]() 2NO(g) ΔH>0。
2NO(g) ΔH>0。
①将含0.8molN2和0.2molO2(近似空气组成)的混合气体充入某密闭容器中,保持1300℃反应达到平衡,测得生成8×10-4molNO。计算该温度下此反应的化学平衡常数K=________(填近似计算结果)。
②汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,原因是________.
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。

①电极A的电极反应式为________;
电极B的电极反应式为________。
②碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时生成SO32-。该反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用电石制取乙炔的装置如下图所示,请填空:

(1)写出仪器的名称:①是________________,②是________________;
(2)制取乙炔的化学方程式是________________;
(3)仪器①中加入的是________________,其目的是________________;
(4)将乙炔通入KMnO4酸性溶液中观察到的现象是________________,乙炔发生了___________反应(填“加成”或“取代”或“氧化”,下同);
(5)为了安全,点燃乙炔前应________________,乙炔燃烧时的实验现象是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com