
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| D.以上说法都不正确。 |
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:单选题
2013年12月2日1时30分,搭载着嫦娥三号的长征三号乙运载火箭在西昌卫星发射中心发射升空并准确入轨,发射圆满成功。火箭的一子级、助推器和二子级使用偏二甲肼[(CH3)2NNH2,结构如图所示]和N2O4作为推进剂,反应如下:(CH3)2NNH2 + 2N2O4=2CO2↑+ 4H2O↑+ 3N2↑,下列有关说法正确的是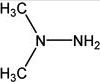
| A.设NA为阿伏伽德罗常数的值,则46g NO2和N2O4的混合气体含有的氧原子数在2NA到4NA之间 |
| B.偏二甲肼分子中既含σ键又含π键 |
| C.(CH3)2NNH2和N2O4都属于分子晶体 |
| D.每反应1mol(CH3)2NNH2有44.8L N2O4被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
以下说法正确的是
| A.共价化合物内部可能有极性键和非极性键 |
| B.原子或离子间相互的吸引力叫化学键 |
| C.非金属元素间只能形成共价键 |
| D.金属元素与非金属元素的原子间只形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是 ( )
| A.氯化硼液态时能导电而固态时不导电 | B.氯化硼中心原子采用sp杂化 |
| C.氯化硼分子呈正三角形,属非极性分子 | D.其分子空间结构类似氯化磷 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
北京大学和中国科学院的化学工作者最近研制出碱金属与C60形成的球碳盐K3C60, 实验测知该物质属于离子晶体,且有良好的超导性,下列K3C60的组成和结构分析正确的是( )
| A.该物质分子式为K3C60 |
| B.K3C60的摩尔质量是837 |
| C.1molK3C60中含有的离子键的数目为63×6.02×1023个 |
| D.K3C60中既有离子键 ,又有共价键 ,在熔融状态下能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对P4S3分子的结构研究表明,该分子中不存在不饱和键,且各原子最外层均已达到8个电子稳定结构。则一个P4S3分子中含有的共价键个数为
| A.7个 | B.9个 | C.19个 | D.不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述不正确的是( )
| A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键 |
| B.向煤中加入生石灰可减少对大气的污染 |
| C.完全由非金属元素组成的化合物可以形成离子化合物 |
| D.由氮气为原料合成氨是氮的固定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NH3分子空间构型是三角锥形,而CH4是正四面体形,这是因为
| A.NH3分子中N为sp2杂化,CH4分子中C为sp3杂化 |
| B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.中心原子N、C都是sp3杂化,但NH3分子中N原子上的一未形成共价键的孤对电子对分子构型有影响,CH4分子中共价键完全相同且分子构型完全对称 |
| D.NH3分子中3个N—H键长大于CH4分子中4个C—H键长 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关粒子间的作用力,说法正确的是
| A.HCI溶于水时.H— Cl键会断裂 |
| B.H2O2分子中只有极性键 |
| C.NH3是以非极性键结合的分子 |
| D.MgCl2中既有离子键,又有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com