
| A. | 二氧化硅是制造光电池的主要原料 | |
| B. | 硅是现代光学及光纤制品的基本原料 | |
| C. | 可用石英坩埚加热氢氧化钠固体 | |
| D. | 在电子工业中,硅是重要的半导体材料 |
分析 A.二氧化硅为绝缘体;
B.二氧化硅具有良好的光学特性;
C.石英主要成分为二氧化硅,二氧化硅能够与氢氧化钠反应;
D.硅的导电性介于导体与绝缘体之间.
解答 解:A.硅是良好的半导体材料,是制造光电池的主要原料,故A错误;
B.二氧化硅具有良好的光学特性,是现代光学及光纤制品的基本原料,故B错误;
C.石英主要成分为二氧化硅,二氧化硅能够与氢氧化钠反应,所以不能用石英坩埚加热氢氧化钠固体,故C错误;
D.硅的导电性介于导体与绝缘体之间,在电子工业中,硅是重要的半导体材料,故D正确;
故选:D.
点评 本题考查了硅及二氧化硅用途,熟悉二者的性质是解题关键,题目难度不大,注意对基础知识的积累.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Fe3+、OHˉ、SO42ˉ | B. | Mg2+、Na+、Clˉ、SO42ˉ | ||
| C. | NH4+、Mg2+、NO3-、OHˉ | D. | H+、K+、NO3-、CO32ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
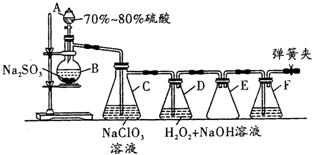 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蓄电池放电时,每消耗0.1molPbO2,则共生成0.1molPbSO4 | |
| B. | 电解硫酸钠溶液时的阳极反应式为4OH--4e=2H2O+O2↑ | |
| C. | 电解一段时间后若硫酸钠溶液中没有晶体析出则c(Na2SO4)不变 | |
| D. | 蓄电池放电一段时间后其电解液中H2SO4的浓度、密度都变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com