
【题目】由单质A与化合物B两种粉末组成的混合物,在一定条件下可按如图所示发生转化:

请回答:
(1)A、B的化学式分别为________、________。
(2)反应①的化学方程式:_____________________________________________________。
(3)写出反应②③的离子方程式:
②________________________________________________________________________;
③________________________________________________________________________。
【答案】Al Fe2O3 Fe2O3+2Al![]() Al2O3+2Fe 2Al+2OH-+2H2O===2AlO2—+3H2↑ 2Fe3++Fe===3Fe2+
Al2O3+2Fe 2Al+2OH-+2H2O===2AlO2—+3H2↑ 2Fe3++Fe===3Fe2+
【解析】
红褐色沉淀I为Fe(OH)3,沉淀H置于空气中变成I,推出H为Fe(OH)2,再利用其他信息和逆向推理得出D为Fe,F为FeCl2,B为Fe2O3,G为FeCl3;沉淀J既能与酸反应,又能与碱反应,则应为Al(OH)3,则E为NaAlO2,K为AlCl3,则单质A与化合物B两种粉末组成的混合物在高温下的反应,应为铝热反应,推出A为Al,B为Fe2O3,C为Al2O3,据此分析解答。
(1)由以上分析可知A为Al,B为Fe2O3,故答案为:Al;Fe2O3;
(2)反应①为Al和Fe2O3在高温下的铝热反应,反应的化学方程式为2Al+Fe2O3![]() 2Fe+Al2O3,故答案为:2Al+Fe2O3
2Fe+Al2O3,故答案为:2Al+Fe2O3![]() 2Fe+Al2O3;
2Fe+Al2O3;
(3)Al和Fe2O3混合物中,只有Al能和NaOH溶液反应,反应②为Al与NaOH溶液反应,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;D为Fe,F为FeCl2,G为FeCl3,Fe3+具有强氧化性,能与Fe反应生成Fe2+,反应③的离子方程式为Fe+2Fe3+=3Fe2+,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Fe+2Fe3+=3Fe2+。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】化学反应是化学实验现象的本质,根据描述回答下列问题:
(1)在BaCl2溶液中通入SO2气体,未见沉淀生成,若先通入或加入下列的另一种物质,再通入SO2不能看到沉淀的有 (填序号).
①Cl2②NaOH③HCl④FeCl3溶液⑤CO2⑥H2S⑦NH3⑧NaClO溶液
(2)图中A、B、C之间有以下的转化关系(副产物已略去);
![]()
则下列说法正确的是
a.若A是非金属单质,则C与水反应的生成物可能是强酸或弱酸
b.若A是金属单质,则C与水反应的生成物可能是强碱
c.若A是化合物,则C与水反应的生成物可能是强酸
(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格相应的“离子方程式”否定这些观点.
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuSO4
错误观点 | “否定的”离子方程式 | |
① | 所有的离子方程式均可以表示一类化学反应 |
|
② | 所有酸碱中和反应均可表示为 H++OH﹣═H2O |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4 +8H2O设计如下原电池,盐桥中装有饱和KCl溶液。下列说法正确的是
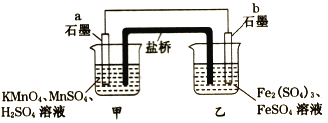
A. b电极上发生还原反应
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为:MnO4-+8H++5e- = Mn2++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种磁性材料的磨削废料(含镍质量分数约21%)主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍,工艺流程如下

回答下列问题:
(1)“酸溶”时,溶液中有Fe3+、Fe2+、Ni2+等生成,废渣的主要成分是__________;金属镍溶解的离子方程式为__________________________________________。
(2)“除铁”时H2O2的作用是___________________,加入碳酸钠的目的是__________________________________________。
(3)“除铜”时,反应的离子方程式为_____________________________________,若用Na2S代替H2S除铜,优点是__________。
(4)已知除钙镁过程在陶瓷容器中进行,NaF的实际用量不能过多的理由为_____________________。
(5)已知常温下Ksp[Ni(OH)2]=2.0×10-15,该流程在“沉镍”过程中需调节溶液pH约为_______,Ni2+才刚好沉淀完全(离子沉淀完全的浓度≤10-5 mol/L;lg2=0.30)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对常温下0.1mol/L的醋酸溶液,以下说法正确的是
A. 由水电离出来的c(H+)=1.0×10-13mol/L
B. c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)
C. 与同浓度的盐酸分别加水稀释10倍:pH(醋酸) <pH(盐酸)
D. 与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO-)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组所做实验的示意图如图所示:图中“→”表示气体流向, M是一种纯净而干燥的气体,Y为另一种气体,E内有红棕色气体产生,实验所用物质只能由下列物质中选取:Na2CO3、Na2O2、NaCl、Na2O、CaCl2、(NH4)2CO3、碱石灰等固体及蒸馏水。据此实验,完成下列填空:
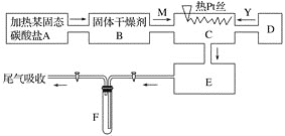
(1)A中所用装置的主要仪器和药品是______________________。
(2)B中所选的干燥剂是________,其作用是______________________________。
(3)C中发生的主要反应的化学方程式:________________________________。
(4)制取Y气体的D装置所用的主要仪器是__________________________。
制取Y气体的化学方程式是________________________。
(5)F中发生反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的元素,它们的单质及其化合物之间有很多转化关系,如通常所说的“铁三角”、“铝三角”等。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是
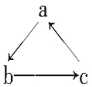
A | B | C | D | |
a | NaHCO3 | Al | Fe | Cu(OH)2 |
b | NaOH | Al2O3 | FeCl3 | CuSO4 |
c | Na2CO3 | NaAlO2 | FeCl2 | CuCl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,其核磁共振氢谱中只有一个吸收峰的是____(填字母,双选)。
A.CH3CH3 B.CH3COOH
C.CH3COOCH3 D.CH3OCH3
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为____,请预测B的核磁共振氢谱上应该有____个吸收峰。
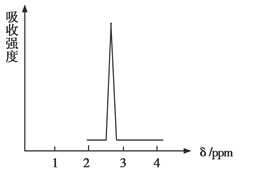
(3)化合物C中各原子数目比为N(C)∶N(H)∶N(O)=1∶2∶1,对化合物C进行质谱分析可得到图示的质谱图,则其分子式为____。若对其进行红外光谱分析,可得出其官能团为____(填名称)。确定化合物C的官能团时,你认为____(填“有”或“没有”)必要进行红外光谱分析。写出化合物C与足量新制氢氧化铜悬浊液反应的化学方程式____________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com