
| 0.01mol |
| 0.05L |
| 0.01mol |
| 0.05L |


科目:高中化学 来源: 题型:
| A、对于平衡Ca(OH)2 (s)?Ca2+(aq)+2OH-(aq),加入NH4Cl溶液,可使Ca(OH)2增多 |
| B、在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Ksp(AgBr)降低 |
| C、温度一定时,当溶液中c(Ag+)和c(Cl-)的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
| D、把固体AgCl加入较浓的KI溶液中振荡,部分AgCl转化为AgI,其原因是AgI比AgCl稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究NO2、SO2、NO、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、NO、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
 某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是a g/cm3.该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX.为了测定RX的相对分子质量,拟定的实验步骤如下:
某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是a g/cm3.该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX.为了测定RX的相对分子质量,拟定的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向某溶液中先加入氯水,再加入KSCN,溶液变为血红色 | 该溶液中必含Fe2+ |
| B | 向硝酸银溶液中滴加NaCl溶液产生白色沉淀,过滤,洗涤沉淀后,向沉淀中加入KI溶液,沉淀变为黄色 | 证明溶解度:AgCl>AgI |
| C | 如图所示装置,打开分液漏斗活塞,锥形瓶中产生气泡,烧杯中出现白色沉淀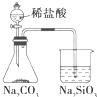 | 证明非金属性Cl>C>Si |
| D | 向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水中,石灰水变浑浊 | 证明该溶液中存在CO32- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com