
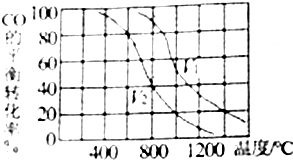
·ÖĪö £Ø1£©·“Ó¦µÄĘ½ŗā³£ŹżK=$\frac{c£ØC{H}_{3}OH£©}{c£ØCO£©£Ø{H}_{2}£©}$£¬ĪĀ¶Č²»±ä£¬Ę½ŗā³£Źż²»±ä£¬Äę·“Ó¦Ę½ŗā³£ŹżĪŖÕż·“Ó¦Ę½ŗā³£ŹżµÄµ¹Źż£¬Ōņ$\frac{c£ØCO£©c£Ø{H}_{2}£©}{c£ØC{H}_{3}OH£©}$ĪŖÄę·“Ó¦µÄĘ½ŗā³£Źż£¬¾Ż“Ė·ÖĪöŃ”Ļī£»
£Ø2£©ĻąĶ¬ĪĀ¶ČĻĀŃ¹ĒæŌ½“óĘ½ŗāÕżĻņ½ųŠŠ£¬Ņ»Ńõ»ÆĢ¼×Ŗ»ÆĀŹŌö“ó£¬ŌņP1£¾P2£»
£Ø3£©800”ꏱ£¬ČŻ»żĪŖV2µÄČŻĘ÷ÖŠ£¬CO×Ŗ»ÆĀŹĪŖ40%£¬½įŗĻČżŠŠ¼ĘĖćĮŠŹ½£¬Ģå»ż·ÖŹżµČÓŚĘäĪļÖŹµÄĮæµÄ·ÖŹż£»
£Ø4£©a£®“߻ƼĮµÄ»īŠŌŹÜĪĀ¶ČÓ°Ļģ£»
b£®ŗćŃ¹ĻĀ³äČėŗ¤Ęų£¬×ÜŃ¹Ōö“ó·ÖŃ¹²»±ä£¬Ę½ŗā²»±ä£»
c£®Éś³ÉĪļÅØ¶Č¼õŠ”·“Ó¦·“Ó¦ĖŁĀŹ¼õŠ”£»
d£®ĪļÖŹµÄĪļÖŹµÄĮæ²»±äĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬£»
£Ø5£©ČōV2=1L£¬600”ę“ļµ½Ę½ŗāŹ±CO×Ŗ»ÆĀŹĪŖ80%£¬½įŗĻ»ÆѧȿŠŠ¼ĘĖćĮŠŹ½¼ĘĖćĘ½ŗāÅØ¶Č£¬¼ĘĖć“ĖŹ±Ę½ŗā³£Źż£¬ÓĆĢāøÉĖłøųÅØ¶Č¼ĘĖćÅضČÉĢŗĶĘ½ŗā³£Źż±Č½ĻÅŠ¶Ļ·“Ó¦½ųŠŠµÄ·½Ļņ£®
½ā“š ½ā£ŗ£Ø1£©Ķ¼Ļó·ÖĪöæÉÖŖĖęĪĀ¶ČÉżøߣ¬Ņ»Ńõ»ÆĢ¼×Ŗ»ÆĀŹ¼õŠ”£¬ĖµĆ÷Ę½ŗāÄęĻņ½ųŠŠ£¬Äę·“Ó¦ĪŖĪüČČ·“Ó¦£¬Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ĻąĶ¬ĪĀ¶ČĻĀŃ¹ĒæŌ½“óĘ½ŗāÕżĻņ½ųŠŠ£¬Ņ»Ńõ»ÆĢ¼×Ŗ»ÆĀŹŌö“ó£¬ŌņP1£¾P2£¬·“Ó¦µÄĘ½ŗā³£ŹżK=$\frac{c£ØC{H}_{3}OH£©}{c£ØCO£©£Ø{H}_{2}£©}$£¬ĪĀ¶Č²»±ä£¬Ę½ŗā³£Źż²»±ä£¬Äę·“Ó¦Ę½ŗā³£ŹżĪŖÕż·“Ó¦Ę½ŗā³£ŹżµÄµ¹Źż£¬Ōņ$\frac{c£ØCO£©c£Ø{H}_{2}£©}{c£ØC{H}_{3}OH£©}$ĪŖÄę·“Ó¦µÄĘ½ŗā³£Źż£¬øıäĪĀ¶ČŗĶÅØ¶Č²»Ó°Ļģ±ČÖµ±ä»Æ£¬ÉżĪĀĘ½ŗāÄęĻņ½ųŠŠ£¬Ōņ$\frac{c£ØCO£©c£Ø{H}_{2}£©}{c£ØC{H}_{3}OH£©}$±ČÖµŌö“󣬽µµĶĪĀ¶ČĘ½ŗāÕżĻņ½ųŠŠ$\frac{c£ØCO£©c£Ø{H}_{2}£©}{c£ØC{H}_{3}OH£©}$¼õŠ”£¬
¹Ź“š°øĪŖ£ŗA£»
£Ø2£©ĻąĶ¬ĪĀ¶ČĻĀŃ¹ĒæŌ½“óĘ½ŗāÕżĻņ½ųŠŠ£¬Ņ»Ńõ»ÆĢ¼×Ŗ»ÆĀŹŌö“ó£¬ŌņP1£¾P2£¬Ģå»żŌ½Š”Ń¹ĒæŌ½“ó£¬ŌņV1£¼V2£¬
¹Ź“š°øĪŖ£ŗ£¼£»
£Ø3£©CO+H2 =CH3OH£¬
ĘšŹ¼Įæ£Ømol£© 2 1 0
±ä»ÆĮæ£Ømol£© 2”Į40% 0.8 0.8
Ņ»Ńõ»ÆĢ¼×Ŗ»ÆĀŹ40%£Ømol£©1.2 0.2 0.8
¼×“¼µÄĢå»ż·ÖŹż=$\frac{0.8}{1.2+0.2+0.8}$”Į100%=36%£¬
¹Ź“š°øĪŖ£ŗ36%£»
£Ø4£©a£®“߻ƼĮµÄ»īŠŌŹÜĪĀ¶ČÓ°Ļģ£¬ĪĀ¶ČŌ½µĶ£¬“߻ƼĮ»īŠŌŌ½²ī£¬²»ĄūÓŚCO“߻ƼÓĒā£¬¹Źa“ķĪó£»
b£®ŗćŃ¹ĻĀ³äČėŗ¤Ęų£¬×ÜŃ¹Ōö“ó·ÖŃ¹²»±ä£¬Ę½ŗā²»±ä£¬¹Źb“ķĪó£»
c£®Éś³ÉĪļÅØ¶Č¼õŠ”·“Ó¦·“Ó¦ĖŁĀŹ¼õŠ”£¬“ÓĘ½ŗāĢåĻµÖŠ·ÖĄė³öCH3OHÄܼõĀżÕż·“Ó¦ĖŁĀŹ£¬¹Źc“ķĪó£»
d£®øĆĢåĻµÖŠH2ÓėCH3OHµÄĪļÖŹµÄĮæĻąµČ£¬ĒŅ±£³Ö²»±ä£¬ĪļÖŹµÄĪļÖŹµÄĮæ²»±äĖµĆ÷ĪļÖŹÅØ¶Č²»±ä£¬·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬¹ŹdÕżČ·£¬
¹Ź“š°øĪŖ£ŗd£»
£Ø5£©ČōV2=1L£¬600”ę“ļµ½Ę½ŗāŹ±CO×Ŗ»ÆĀŹĪŖ80%£¬½įŗĻ»ÆѧȿŠŠ¼ĘĖćĮŠŹ½¼ĘĖćĘ½ŗāÅØ¶Č£¬
CO+H2 =CH3OH£¬
ĘšŹ¼Įæ£Ømol£© 2 1 0
±ä»ÆĮæ£Ømol£© 2”Į80% 1.6 1.6
Ę½ŗāĮæ£Ømol£© 0.4 0.4 1.6
Ģå»żĪŖ1L£¬ÓĆĪļÖŹµÄĮæ“śĢęĘ½ŗāÅØ¶Č¼ĘĖć“ĖŹ±Ę½ŗā³£ŹżK=$\frac{1.6}{0.4”Į0.4}$=10£¬
600”ę“ļµ½Ę½ŗāŹ±£¬ŌŁĻņČŻĘ÷ÖŠ³äČėCO”¢H2”¢CH3OHø÷0.5mol£¬ÓĆĢāøÉĖłøųÅØ¶Č¼ĘĖćÅضČÉĢŗĶĘ½ŗā³£Źż±Č½ĻÅŠ¶Ļ·“Ó¦½ųŠŠµÄ·½Ļņ£¬Qc=$\frac{1.6+0.5}{£Ø0.4+0.5£©”Į£Ø0.4+0.5£©}$=2.6£¼K=10£¬·“Ó¦ÕżĻņ½ųŠŠ£¬vÕż£¾vÄę£¬
¹Ź“š°øĪŖ£ŗ£¾£®
µćĘĄ ±¾Ģāæ¼²éĮĖ»Æѧ·“Ó¦ĖŁĀŹ”¢»ÆŃ§Ę½ŗāÓ°ĻģŅņĖŲŗĶÓŠ¹Ų¼ĘĖć£¬Ö÷ŅŖŹĒĶ¼Ļó·ÖĪöÅŠ¶Ļ”¢»ÆŃ§Ę½ŗāŌĄķŗĶøÅÄīµÄŹµÖŹĄķ½āÓ¦ÓĆ£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øĆĪļÖŹŹōÓŚŃõ»ÆĪļ | |
| B£® | ŅŅĖįÓėŅŅ“¼·“Ӧɜ³ÉŅŅĖįŅŅõ„ŹōÓŚČ”“ś·“Ó¦ | |
| C£® | øĆĪļÖŹµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ88 | |
| D£® | ŅŅĖįŅŅõ„Č¼ÉÕÓŠ¶žŃõ»ÆĢ¼ŗĶĖ®Éś³É |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃ鱹ŗÅ | ŹŅĪĀĻĀ£¬ŹŌ¹ÜÖŠĖł¼ÓŹŌ¼Į¼°ĘäÓĆĮæ/mL | ŹŅĪĀĻĀČÜŅŗŃÕÉ«ĶŹÖĮĪŽÉ«ĖłŠčŹ±¼ä/min | |||
| 0.6 mol/L H2C2O4ČÜŅŗ | H2O | 0.2 mol/L KMnO4ČÜŅŗ | 3 mol/L Ļ”ĮņĖį | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
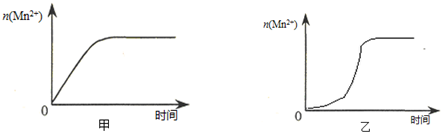
| ŹµŃ鱹ŗÅ | ŹŅĪĀĻĀ£¬ŹŌ¹ÜÖŠĖł¼ÓŹŌ¼Į¼°ĘäÓĆĮæ/mL | ŌŁĻņŹŌ¹ÜÖŠ¼ÓČėÉŁĮæ¹ĢĢå | ŹŅĪĀĻĀČÜŅŗŃÕÉ«ĶŹÖĮĪŽÉ«ĖłŠčŹ±¼ä/min | |||
| 0.6 mol/L H2C2O4ČÜŅŗ | H2O | 0.2 mol/L KMnO4ČÜŅŗ | 3 mol/L Ļ”ĮņĖį | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | ||
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
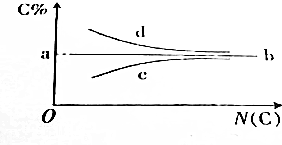
| A£® | aµćµÄÖµæĻ¶ØŹĒ85.7% | B£® | Āś×ćbĻß×ߏʵÄĢžĶØŹ½ĪŖCnH2n | ||
| C£® | Āś×ćcĻß×ߏʵÄĢžŅ»¶ØŹĒĶéĢž | D£® | Āś×ćdĻß×ߏʵÄĢžŅ»¶ØŹĒČ²Ģž |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŃĪĖįŗĶĒāŃõ»ÆÄĘČÜŅŗ»ģŗĻ | B£® | ×ĘČȵÄľĢæÓė¶žŃõ»ÆĢ¼·“Ó¦ | ||
| C£® | Šæ·ÅČėĻ”ĮņĖįÖŠ | D£® | Ģ¼²»ĶźČ«Č¼ÉÕÉś³ÉŅ»Ńõ»ÆĢ¼ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com