
| A. | HCHO | B. | CH3CHO | C. | CH3CH2CHO | D. | CH3CH(CH3)CHO |
分析 根据银氨反应中,n(甲醛):n(银)=1:4,其它饱和一元醛n(醛):n(银)=1:2,求出醛的物质的量,然后求出相对分子质量即可解答.
解答 解:10.8g银的物质的量为n=$\frac{10.8g}{108g/mol}$=0.1mol,
银氨反应中,n(甲醛):n(银)=1:4,甲醛的物质的量为0.025mol,所以醛的摩尔质量为M=$\frac{2.9g}{0.025mol}$=116g/mol,显然不等于HCHO的相对分子质量30;
其它饱和一元醛醛n(醛):n(银)=1:2,醛的物质的量为0.05mol,所以醛的摩尔质量为M=$\frac{2.9g}{0.05mol}$=58g/mol,
即:该饱和一元醛的相对分子质量58,饱和一元醛的通式为CnH2nO,则14n+16=58,解得:n=3,为丙醛,结构简式为:CH3CH2CHO,
故选C.
点评 本题考查了化学方程式的计算,题目难度中等,明确银镜反应原理为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
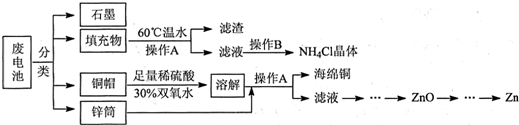
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
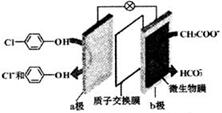 利用微生物电池处理含乙酸钠和对氯酚(
利用微生物电池处理含乙酸钠和对氯酚(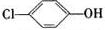 )的废水,工作原理如图所示.下列说法正确的是( )
)的废水,工作原理如图所示.下列说法正确的是( )| A. | 电极b是正极 | B. | 质子从a极移向b极 | ||
| C. | 处理后的废水pH升高 | D. | a极的电极反应式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ•mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
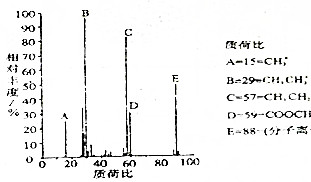 某有机物A的最简式为C2H4O,其质谱图如图所示:有机物A的质谱图和主要碎片的归属
某有机物A的最简式为C2H4O,其质谱图如图所示:有机物A的质谱图和主要碎片的归属查看答案和解析>>
科目:高中化学 来源: 题型:解答题
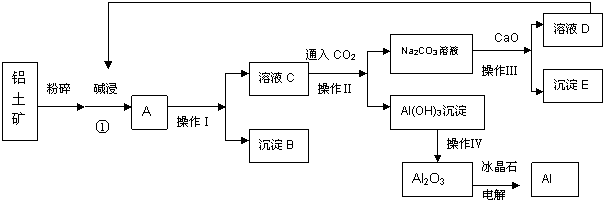
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ | |
| C. | 反应至4min时,若HCl的浓度为0.12mol•L-1,则H2的反应速率为:0.015mol/(L•min) | |
| D. | 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol•L-1的NaOH溶液恰好反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com