
| A. | 0.1 mol•L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)=c(OH-) | |
| B. | 常温下等体积pH相同的CH3COOH和HCl溶液,消耗NaOH的量一样多 | |
| C. | 常温下,醋酸钠与醋酸的混合溶液pH=7:则c(Na+)>c(CH3COO-) | |
| D. | 0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2 c(CO32-)+c(OH-) |
分析 A.硫酸铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,但水解程度较小;
B.常温下pH相同的醋酸和盐酸,醋酸浓度大于盐酸,相同体积相同pH的醋酸和盐酸,消耗的NaOH的量与酸的物质的量成正比;
C.常温下,醋酸钠和醋酸的混合溶液pH=7,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒判断c(Na+)、c(CH3COO-)相对大小;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:A.硫酸铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c(H+)>c(OH-),但水解程度较小,根据电荷守恒得c(NH4+)>c(SO42-),离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),故A错误;
B.常温下pH相同的醋酸和盐酸,醋酸浓度大于盐酸,相同体积相同pH的醋酸和盐酸,消耗的NaOH的量与酸的物质的量成正比,所以醋酸消耗的NaOH多,故B错误;
C.常温下,醋酸钠和醋酸的混合溶液pH=7,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)=c(CH3COO-),故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2 c(CO32-)+c(OH-),故D正确;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质成分及其性质、溶液酸碱性、弱电解质电离和盐类水解是解本题关键,注意电荷守恒和物料守恒的灵活运用,题目难度不大.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 沸点:XW2>Y2W | |
| C. | 最高价氧化物对应的水化物的酸性:X>Z | |
| D. | 简单氢化物的热稳定性:Z<W |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 迷迭香酸属于芳香族化合物 | |
| B. | 1mol迷迭香酸最多能和9mol氢气发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、取代反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
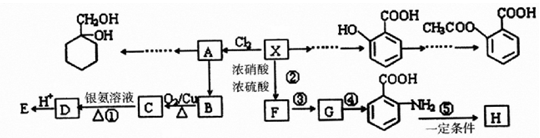
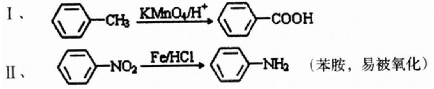
 ;
;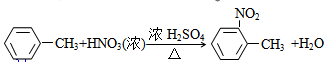 ;
;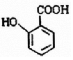 有多种同分异构体,写出符合下列条件的所有结构简式:
有多种同分异构体,写出符合下列条件的所有结构简式: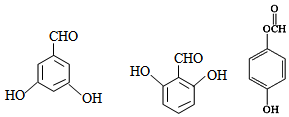 ;
;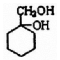 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)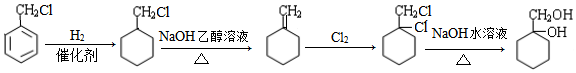 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
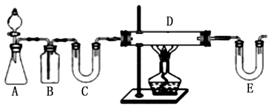

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )| A. | 电池工作时,正极反应式为O2+2H2O+4e-═4OH- | |
| B. | 电解时,电子流动路径是:负极-→外电路-→阴极-→溶液-→阳极-→正极 | |
| C. | 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时前者的还原性强于后者 | |
| D. | 当电池中消耗0.02g H2时,a极周围会产生0.02gH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO${\;}_{4}^{2-}$、Fe3+ | |
| B. | 常温下$\frac{{K}_{w}}{c({H}^{+})}$=0.1mol•L-1的溶液:K+、Na+、SiO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ | |
| C. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、MnO${\;}_{4}^{-}$、Cl- | |
| D. | 澄清透明溶液:Al3+、Na+、SO${\;}_{4}^{2-}$、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定不含CH4和H2,可能含有NO2和NH3 | |
| B. | 一定含有CO,可能含HCl和CO2 | |
| C. | 只含有CO和HCl | |
| D. | 一定含CO和HCl,可能含CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com