
| A�� | COȼ�յ��Ȼ�ѧ����ʽΪ2CO��g��+O2��g���T2CO2��g����H=-282.8kJ•mol-1 | |
| B�� | H2ȼ�յ��Ȼ�ѧ����ʽΪ2H2��g��+O2��g���T2H2O��g����H=-571.6kJ•mol-1 | |
| C�� | ȼ��ǰ���������CO���������Ϊ40% | |
| D�� | ȼ�պ�IJ���ȫ���������Ĺ����������ÿɲ���0.125mol O2 |
���� ȼ����Ϊ1mol������ȼ�������ȶ�������ų��������������ʵ��������������ȣ�H2��CO��ɵĻ������5.6L����������ʵ���Ϊ$\frac{5.6L}{22.4L/mol}$=0.25mol�������ȼ�պų�������Ϊ79.5kJ��������Һ̬ˮ����������һ����̼ȼ���ȵ��Ȼ�ѧ����ʽ�����������ʵ���Ϊx��һ����̼���ʵ���Ϊy����$\left\{\begin{array}{l}{x+y=0.25}\\{285.8x+282.8y=79.5}\end{array}\right.$
���x=0.1��y=0.15���Դ������
��� �⣺A��CO��ȼ����Ϊ-282.8kJ•mol-1����COȼ�յ��Ȼ�ѧ����ʽΪCO��g��+$\frac{1}{2}$O2��g���TCO2��g����H=-282.8kJ•mol-1����A����
B��H2��ȼ����Ϊ-285.8kJ•mol-1�������ʵ��������������ȣ���H2ȼ�յ��Ȼ�ѧ����ʽΪ2H2��g��+O2��g���T2H2O��l����H=-571.6kJ•mol-1����B����
C��������������֪���������Ϊ0.25mol��COΪ0.15mol����ȼ��ǰ���������CO���������Ϊ$\frac{0.15}{0.25}$��100%=60%����C����
D������ˮ�Ͷ�����̼�ֱ�Ϊ0.1mol��0.15mol����2CO2+2Na2O2�T2Na2CO3+O2��2H2O+2Na2O2�T4NaOH+O2����֪�������������ʵ���Ϊ0.15mol��$\frac{1}{2}$+0��mol��$\frac{1}{2}$=0.125mol����D��ȷ��
��ѡD��
���� ���⿼���Ȼ�ѧ����ʽ��Ϊ��Ƶ���㣬����ȼ���ȡ���Ӧ�������仯Ϊ���Ĺؼ������ط�������������Ŀ��飬ע�����ʵ��������������ȣ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��1��1 | B�� | 2��1��1 | C�� | 3��1��1 | D�� | 1��2��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SiO2�����������ﲻ���κ��ᷴӦ | |
| B�� | ˮ�������ڴ�ţ����а�ɫ��״�������� | |
| C�� | ����ʱSiO2�ܸ�Na2CO3��Ӧ�ų�CO2�����Թ�������Ա�̼��ǿ | |
| D�� | SiO2��CO2��ѧ������Ȼ���ƣ������ߵĽṹ��ȫ��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ձ� | B�� | ����̨������Ȧ�� | C�� | ©�� | D�� | ҩ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
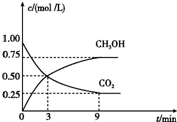 �й�������ŵ����2020�꣬��λGDP������̼�ŷű�2005���½�40%��50%��
�й�������ŵ����2020�꣬��λGDP������̼�ŷű�2005���½�40%��50%��| �¶�/�� | 0 | 100 | 200 | 300 | 400 |
| ƽ�ⳣ�� | 667 | 13 | 1.9��10-2 | 2.4��10-4 | 1��10-5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
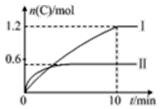 ��2L�ĺ����ܱ������г���A��g����B��g����������ӦA��g��+B��g��?2C��g��+D��s����H=a kJ•mol-1��ʵ�����ݺͽ���ֱ������ͼ��ʾ������˵����ȷ���ǣ�������
��2L�ĺ����ܱ������г���A��g����B��g����������ӦA��g��+B��g��?2C��g��+D��s����H=a kJ•mol-1��ʵ�����ݺͽ���ֱ������ͼ��ʾ������˵����ȷ���ǣ�������| ʵ�� ��� | �¶� | ��ʼ���ʵ��� | ���� �仯 | |
| A | B | |||
| �� | 600�� | 1 mol | 3 mol | 96 kJ |
| �� | 800�� | 1.5 mol | 0.5 mol | -- |
| A�� | ��������ʽ��a=-160 | |
| B�� | ʵ����У�10 min��ƽ������v��B��=0.06 mol•L-1•min-1 | |
| C�� | 600��ʱ���÷�Ӧ��ƽ�ⳣ����0.45 | |
| D�� | ��ʵ����ƽ����ϵ���ٳ���0.5 mol A��1.5 mol B��A��ת���ʼ�С |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com