
【题目】十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
汽车的排气管上安装“催化转化器”,发生反应①:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=-746.5 kJ·mol-1。
2CO2(g)+N2(g) △H=-746.5 kJ·mol-1。
(1)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min)NO的物质的量随时间变化如图。

①图中a,b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__。(填“a”或“b”)
②T℃时,该反应的化学平衡常数K=__;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将__移动。(填“向左”、“向右”或“不”)
③15min时,若改变外界反应条件,导致n(NO)发生图中所示变化,则改变的条件可能是___(任答一条即可)。
④又已知:反应②N2(g)+O2(g)![]() 2NO(g) △H2=+180.5 kJ·mol-1,则CO的燃烧热△H=__。
2NO(g) △H2=+180.5 kJ·mol-1,则CO的燃烧热△H=__。
(2)在密闭容器中充入5 mol CO和4 mol NO,发生上述反应①,如图为平衡时NO的体积分数与温度、压强的关系。
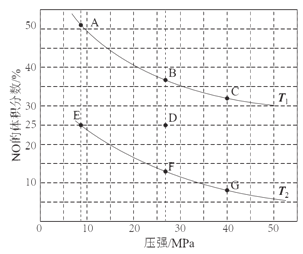
①温度:T1__T2(填“<”或“>”)。
②若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____点。
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝原理,其脱硝率(脱硝率即NO的转化率)与温度、负载率(分子筛中催化剂的质量分数)的关系如图所示。
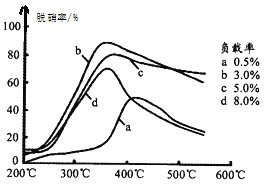
为达到最佳脱硝效果,应采取的条件是________。
【答案】b 5L/mol 不 加压(或增加CO的物质的量浓度或减少生成物浓度或降温等) 283.0kJ·mol-1 > A 350℃左右、负载率3%
【解析】
(1)①使用催化剂缩短到平衡状态用时来判断;
②根据三段法计算平衡常数,比较Qc与平衡常数K大小判断移动方向;
③用n(NO)发生图中所示变化判断改变的条件;
④用盖斯定律来计算CO的燃烧热;
(2)①根据反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=-746kJmol-1,升高温度,平衡逆向移动,所以NO的体积分数会增大;
N2(g)+2CO2(g)△H=-746kJmol-1,升高温度,平衡逆向移动,所以NO的体积分数会增大;
②若在D点对反应容器升温的同时扩大体积使体系压强减小,则平衡会逆向移动;
③从图中判断达到最佳脱硝效果应采取的条件。
(1)①使用催化剂缩短到平衡状态用时,因此催化剂面积较大的曲线是b;
② 根据化学反应速率的数学表达式,v(CO)=(0.4-0.2)/(2×10)mol/(L·min)=0.01 mol/(L·min);
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
起始浓度: 0.2 0.2 0 0
变化浓度: 0.1 0.1 0.1 0.05
平衡浓度: 0.1 0.1 0.1 0.05,
根据平衡常数的表达式,![]() =5;此时CO的浓度为0.2mol·L-1,CO2的浓度为0.2mol·L-1,代数上式,此时的浓度商为5,与化学平衡常数相等,即平衡不移动;
=5;此时CO的浓度为0.2mol·L-1,CO2的浓度为0.2mol·L-1,代数上式,此时的浓度商为5,与化学平衡常数相等,即平衡不移动;
③15min时,NO的物质的量减少,将N2移出减少生成物浓度、加压等,平衡向正反应方向移动,NO的物质的量减小,
④用盖斯定律结合反应①与反应来② ,![]() 计算CO的燃烧热283.0kJ·mol-1
计算CO的燃烧热283.0kJ·mol-1
(3)①根据反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=-746kJmol-1,升高温度,平衡逆向移动,所以NO的体积分数会增大,即T1>T2。
N2(g)+2CO2(g)△H=-746kJmol-1,升高温度,平衡逆向移动,所以NO的体积分数会增大,即T1>T2。
②若在D点对反应容器升温的同时扩大体积使体系压强减小,则平衡会逆向移动,NO的体积分数增加,重新达到的平衡状态可能是图中A点。
③从图中判断达到最佳脱硝效果应采取的条件350℃左右、负载率3%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】锰及其化合物在工农业生产和科技领域具有广泛的应用。
Ⅰ.溶液中的Mn2+可被酸性(NH4)2S2O8溶液氧化为MnO4-,同时(NH4)2S2O8被还原为SO42-,该方法可用于检验Mn2+。
(1)用酸性(NH4)2S2O8溶液检验Mn2+时的实验现象为____。
(2)该反应的离子方程式为____。
(3)已知H2S2O8中硫的化合价为+6,若硫酸的结构简式为![]() ,则H2S2O8的结构简式为____。
,则H2S2O8的结构简式为____。
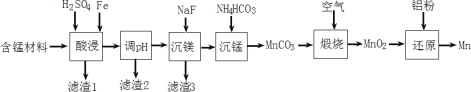
Ⅱ.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn的工艺流程如图所示。
已知:①部分难溶物的溶度积常数如下表所示。
难溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
溶度积常数 | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
②当溶液中离子浓度≤1.0×10-5molL-1时,可认为该离子沉淀完全。
(1)“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为____;该过程中浸出时间和液固比对锰浸出率的影响分别如图所示。
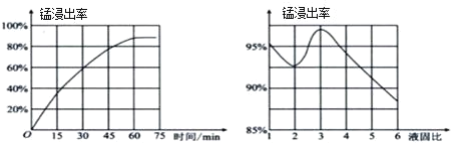
则适宜的浸出时间和液固比分别为____、____。
(2)若“酸浸”后所得滤液中c(Mn2+)=0.18molL-1,则应“调pH”的范围为____。
(3)“煅烧”反应中氧化剂与还原剂的物质的量之比为____。“还原”时发生的置换反应在化学上又叫作____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A、B、H都属于盐类,A和B的水溶液都能使酚酞变红,H是人们日常生活中最常用的食品添加剂之一,E是淡黄色固体
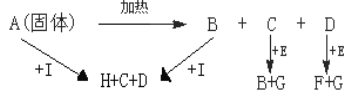
(1)写出下列物质的化学式E______________,I_______________
(2)写出下列反应的化学方程式
A→B+C+D__________________________________________
C+E→B+G__________________________________________
D+E→F+G__________________________________________
(3)写出下列反应的离子方程式
A+I→H+C+D________________________________________
B+I→H+C+D________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g)+B(g)=2AB(g)的能量交化如图所示。下列有关叙述不正确的是
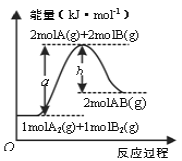
A.AB(g)的键能为b kJ·mol-1
B.反应热△H=+(a-b)kJ·mol-1
C.该反应中反应物的总能量低于生成物的总能量
D.断裂1 mol A-A键和1 mol B-B键,吸收a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,下列叙述不正确的是
Z(g)+W(s) ΔH>0,下列叙述不正确的是
A. 在容器中加入氩气,反应速率不变
B. 加入少量W,逆反应速率不变
C. 升高温度,正反应速率增大,逆反应速率减小
D. 将容器的体积压缩,可增大单位体积内活化分子数,有效碰撞次数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)Ⅰ.目前我国锅炉烟气脱硝技术有新发现,科学家对O3氧化烟气脱硝同时制硝酸进行了实验研究,其生产硝酸的机理如下:
![]()
回答下列问题:
(1)NO3分子内存在两个过氧键,且氧均满足8电子稳定结构,请写出NO3中N的化合价______;NO3极不稳定,常温下即可爆炸分解,试从电子成键角度解释NO3不稳定的原因:__________________。
(2)N2O5与O3作用也能生成NO3与氧气,根据反应前后同种元素,价态相同,不参与氧化还原反应的原则,请分析反应N2O5+O3![]() 2NO3+O2中,N2O5的作用是__________________(填“氧化剂”“还原剂”或“既是氧化剂,又是还原剂”)。
2NO3+O2中,N2O5的作用是__________________(填“氧化剂”“还原剂”或“既是氧化剂,又是还原剂”)。
(3)请写出在有水存在时,O3与NO以物质的量之比为3∶2完全反应的总化学方程式___________。
Ⅱ.下图为某学习兴趣小组对Cu与稀硝酸反应的改进实验装置图:
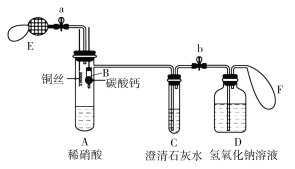
(4)按如图组装好仪器,检查气密性后,装药品,实验时,先关闭a,打开b,将装置B下移,使之与稀硝酸接触产生气体,当________________(填实验现象),立刻将之上提,并关闭b,这样操作的目的为________________________________。
(5)将铜丝下移,使之与稀硝酸接触,A中现象是________________,稍后将铜丝上拉,使之与稀硝酸分离;打开a,挤压E,使少量空气进入A中,A中现象是______________。
(6)打开b,交替挤压E和F,至装置内氮氧化物气体被氢氧化钠溶液充分吸收,写出NO2气体与氢氧化钠溶液充分反应的离子方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某热再生电池工作原理如图所示。放电后,可利用废热进行充电。已知电池总反应:Cu2++4NH3![]() [Cu(NH3)4]2+ ΔH<0。下列说法正确的是( )
[Cu(NH3)4]2+ ΔH<0。下列说法正确的是( )

A.充电时,能量转化形式主要为电能到化学能
B.放电时,负极反应为NH3-8e-+9OH-=NO3-+6H2O
C.a为阳离子交换膜
D.放电时,左池Cu电极减少6.4g时,右池溶液质量减少18.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
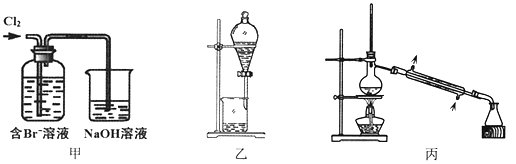
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图所示,下列说法正确的是
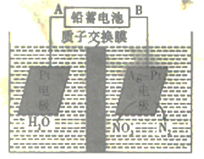
A.电源正极为B
B.H+由右侧通过交换膜移动到左侧
C.该电解池的阴极反应式为2NO3-+12H+ +10e-=N2↑+6H2O
D.标况下,若有2. 24LN2生成,理论上铅蓄电池中有20.7克Pb消耗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com