
【题目】某课外活动小组为了测定铜铁合金中铁的质量分数,现取铜铁合金样品20.0 g,将80.0 g稀硫酸平均分成4份,分4次逐渐加入到样品中,每次充分反应后测得剩余固体质量见下表

试求:
(1)20.0 g铜铁合金中,铜的质量是______。
(2)铜铁合金中,铁元素的质量分数是______。
(3)20 g稀硫酸溶液中溶质质量是______。
【答案】13 g 35% 4.9 g
【解析】
(1)从表中数据可以看出,加入第4次硫酸时,固体的质量不再改变,说明此时的固体全部是铜,从而得出20.0 g铜铁合金中铜的质量。
(2) 铜铁合金样品20.0 g,求出铜的质量,也就求出了铁的质量,从而铁元素的质量分数。
(3)第一、第二份硫酸,都与铁发生了完全反应,由铁的质量,利用方程式,可求出硫酸的物质的量,从而求出20 g稀硫酸溶液中溶质质量。
(1)由表中数据可知,前两次每20 g稀硫酸最多消耗2.8 g铁,第三次加20 g稀硫酸只消耗了1.4 g铁,说明铁已全部参与反应,硫酸有剩余,剩余的固体全部是铜,其质量为13 g。答案为:13 g;
(2)铁的质量分数为![]() ×100%=35%。答案为:35%;
×100%=35%。答案为:35%;
(3)第一次稀硫酸反应的铁的质量=20 g-17.2 g=2.8 g,
由Fe+H2SO4=FeSO4+H2↑可知,
硫酸的质量=2.8 g÷56 g·mol-1×98 g·mol-1=4.9 g。答案为:4.9 g。


科目:高中化学 来源: 题型:
【题目】(1)已知食盐常加入KIO3 来补充碘元素,检验食盐中是否加碘,可利用如下反应:__KIO3+___KI+___H2SO4═___K2SO4+___I2+___H2O(配平反应方程式)。
①利用上述反应检验食盐中是否加碘,所需试剂是________(填下列选项的序号)
A、碘水B、KI溶液C、淀粉溶液D、稀硫酸E、AgNO3溶液
②如果反应中转移0.2mol电子,则生成I2的物质的量为___________
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)若反应中消耗Cl2 1.5mol,则被氧化的NH3在标准状况下的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中都有非常重要的作用。下表(元素周期表前三周期的一部分)列出了①~⑦七种元素在周期表中的位置。
① | ② | ③ | |||
④ | ⑤ | ⑥ | ⑦ |
请回答:
(1)②所代表元素的名称为______
(2)七种元素中,非金属性最强的元素是______(填元素符号),最高价氧化物的水化物酸性最强的是_______(填化学式),最高正化合价与最低负化合价的代数和为4的元素是_______(填元素符号)。
(3)②、④、⑥所对应元素中原子半径最小的是______(填元素符号),简单离子半径最大的是______(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,某科研团队成功合成了Ni—Fe双原子催化剂(Ni/Fe—C—N),并应用于高效催化CO2还原。回答下列问题:
(1)基态铁原子的价电子轨道排布图为__。铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+__Fe3+(填“>”或“<”),原因是__。
(2)C、N、O三种元素的第一电离能由大到小的顺序为__。
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与CO提供配位的电子总数之和为18,则n=___;该化合物易溶于苯及四氯化碳等有机溶剂,原因是___。
(4)二茂铁的结构为![]() ,由Fe2+和
,由Fe2+和![]() (环戊二烯基负离子)构成。一个
(环戊二烯基负离子)构成。一个![]() 中σ键总数为__,C原子的杂化轨道类型为__。
中σ键总数为__,C原子的杂化轨道类型为__。
(5)某C、Fe合金的晶胞结构如图所示:
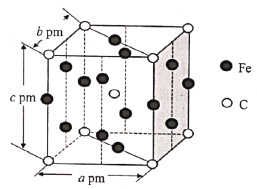
该合金的化学式为__,若该晶体的晶胞参数为apm、bpm、cpm,α=β=γ=90o,密度为ρg·cm-3,则NA为__(写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氟碳铈矿(主要成分![]() )提取
)提取![]() 的一种工艺流程如下:
的一种工艺流程如下:

请回答下列问题:
(1)脱氟过程的实验操作是________,酸浸过程中加入![]() 的作用是________。
的作用是________。
(2)常温下,若溶液中的![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() 为________(己知
为________(己知![]() )。
)。
(3)准确称取![]() 样品置于锥形瓶中,加入适量过硫酸铵
样品置于锥形瓶中,加入适量过硫酸铵![]() 溶液将
溶液将![]() 氧化为
氧化为![]() ,再用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗30.00mL标准溶液。(己知:
,再用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗30.00mL标准溶液。(己知:![]() )
)
①已知:过二硫化酸的结构式为 ,其中
,其中![]() 元素的化合价为________。
元素的化合价为________。
②该样品中![]() 的质量分数为________(精确到
的质量分数为________(精确到![]() )。
)。
③若使用久置的![]() 标准溶液进行滴定,测得该
标准溶液进行滴定,测得该![]() 样品的质量分数将________(填“偏大”“偏小”或“无影响”)。
样品的质量分数将________(填“偏大”“偏小”或“无影响”)。
(4)脱氟过程中产生的![]() 因活性弱于熔融的氟氢化钾
因活性弱于熔融的氟氢化钾![]() ,故现代工业以电解熔融的氟氢化钾和氟化氢
,故现代工业以电解熔融的氟氢化钾和氟化氢![]() 混合物制备氟单质,电原理为
混合物制备氟单质,电原理为![]() 装置如图所示。已知
装置如图所示。已知![]() 是一种酸式盐,则阴极上发生的电极反应式为________。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是________。
是一种酸式盐,则阴极上发生的电极反应式为________。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的钠投入到24.6 g水中,反应后得到氢氧化钠溶液31.2 g。
(1)所得氢氧化钠溶液中溶质的物质的量为__________。
(2)参加反应钠的质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活中有广泛应用。
(1)![]() 可用作净水剂,也可用于无线电印刷电路做蚀刻剂。某化学兴趣小组利用如图所示装置向
可用作净水剂,也可用于无线电印刷电路做蚀刻剂。某化学兴趣小组利用如图所示装置向![]() 的铁屑中通入
的铁屑中通入![]() 生产无水
生产无水![]() 。已知:
。已知:![]() 固体呈黑棕色、易潮解、
固体呈黑棕色、易潮解、![]() 左右时升华。
左右时升华。
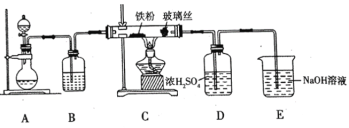
回答下列问题
①写出用高锰酸钾和浓盐酸在装置![]() 中制备氯气的离子方程式_____。
中制备氯气的离子方程式_____。
②装置![]() 中加入的试剂是_____,装置
中加入的试剂是_____,装置![]() 中玻璃丝的作用是_____,
中玻璃丝的作用是_____,![]() 中
中![]() 溶液的作用是_____。
溶液的作用是_____。
③有同学认为气体通入装置![]() 前应除去其中含有的
前应除去其中含有的![]() ,改进措施为_____。
,改进措施为_____。
(2)一种新型高效净水剂![]() (聚合氯化铁铝
(聚合氯化铁铝![]() ,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取
,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取![]() ,设计生产流程如下:
,设计生产流程如下:
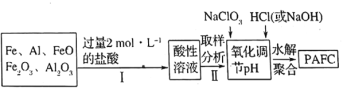
①实验室现需用![]() 的稀盐酸,欲用
的稀盐酸,欲用![]() 的浓盐酸配制,则所需浓盐酸体积为________。
的浓盐酸配制,则所需浓盐酸体积为________。
②![]() 中
中![]() 显________价,
显________价,![]() 在强酸性和强碱性溶液中均________稳定存在(填“能”或“不能”)。
在强酸性和强碱性溶液中均________稳定存在(填“能”或“不能”)。
③步骤Ⅱ中取样分析的目的是________。
A.测定溶液中![]() 与
与![]() 的含量比 B.测定原料是否完全溶解
的含量比 B.测定原料是否完全溶解
C.测定溶液中![]() 的含量,以确定加入
的含量,以确定加入![]() 的量 D.测定溶液中
的量 D.测定溶液中![]() 的含量
的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 2H2S+SO2=3S↓+2H2O中,氧化产物和还原产物物质的量之比为2:1
B. 4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O中,氧化剂和还原剂物质的量之比为5:2
C. 3I2+6KOH![]() 5KI+KIO3+3H2O中,被氧化和被还原的碘原子物质的量之比为1:5
5KI+KIO3+3H2O中,被氧化和被还原的碘原子物质的量之比为1:5
D. 2FeS+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+2S↓+6H2O中,发生氧化反应和发生还原反应的硫原子物质的量之比为2:3
Fe2(SO4)3+3SO2↑+2S↓+6H2O中,发生氧化反应和发生还原反应的硫原子物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。结合氯气的物理性质,判断下列叙述中不正确是________________(填序号)。
MnCl2+Cl2↑+2H2O。结合氯气的物理性质,判断下列叙述中不正确是________________(填序号)。
①加热盛有二氧化锰、浓盐酸的烧瓶,瓶内充满黄绿色气体。
②氯气的密度比空气大,常用向上排空气法收集氯气。
③闻氯气气味时,用手轻轻在集气瓶口扇动,使极少量氯气飘进鼻孔。
④在充满氯气的集气瓶内加水,盖严后振荡,瓶内气体颜色变浅,液体变为黄绿色。
⑤氯气易液化,在低温和加压的条件下可以转变为液态(液氯)和固态。
⑥氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com