
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
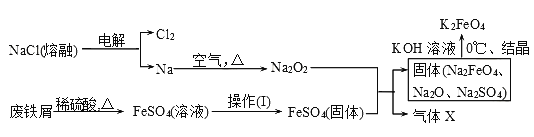
(1)工业上的湿法制备方法是用KClO与Fe(OH)3在KOH存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为________________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:
①操作(Ⅰ)的方法为_____________________________________,隔绝空气减压干燥。
②检验产生X气体的方法是________________。
③最终在溶液中得到K2FeO4晶体利用的原理是____________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液,
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)2溶液的体积,做3次平行实验,平均消耗(NH4)2Fe(SO4)2溶液的体积30.00 mL。
已知:滴定时发生的反应为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mL K2FeO4溶液加入到锥形瓶中所用的仪器是______________。
②写出步骤3中发生反应的离子方程式__________________________。
③步骤5中能否不加指示剂_________,原因是_________________________________。
④根据上述实验数据,测定该样品中K2FeO4的质量分数为__________。
(4)配制0.1mol·L-1的K2FeO4,调节溶液pH,含铁离子在水溶液中的存在形态如图所示。下列说法正确的是__________ (填字母)。

A.pH=2时,c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1
B.向pH=10的这种溶液中加硫酸铵,则HFeO4-的分布分数逐渐增大
C.向pH=1的溶液中加HI溶液,发生反应的离子方程式为:H2FeO4+H+=H3FeO4+
D.将K2FeO4晶体溶于水,水溶液呈弱碱性
【答案】⑴3:2
⑵①蒸发浓缩、冷却结晶、过滤、洗涤
②用带火星的木条接触气体 ③K2FeO4在0℃时的溶解度比Na2FeO4、NaOH、KOH、Na2SO4小
⑶①酸式滴定管 ②CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH- ③否,因为K2Cr2O7溶液为橙色、Fe3+的溶液为黄色,颜色变化不明显 ④0.792(或79.2%)
⑷ A D
【解析】(1)本题考查氧化还原反应得失电子守恒,根据得失电子数目守恒,即n(KClO)×2=n[Fe(OH)3]×3,n(KClO):n[Fe(OH)3]=3:2;(2)本题考查物质的制备,①从FeSO4溶液中得到FeSO4固体,操作I的方法是蒸发浓缩、冷却结晶、过滤、洗涤得到FeSO4;②发生反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,气体X为O2,用带火星的木条接触气体,如果带火星的木条复燃,说明是氧气;③利用K2FeO4在0℃时的溶解度比Na2FeO4、NaOH、KOH、Na2SO4小;(3)本题考查滴定实验,①K2FeO4具有氧化性,能腐蚀橡胶,因此不能用带橡胶的碱式滴定管,步骤2中准确量取25.00mLK2FeO4溶液加入到锥形瓶中,所用的仪器应是酸式滴定管;②步骤3中发生反应是CrO2-+FeO42-→Fe(OH)3↓+CrO42-,Cr的化合价由+3价→+6价,化合价升高3价,Fe的化合价由+6价→+3价,化合价降低3价,最小公倍数为3,根据原子守恒和电荷守恒,配平其他,即离子反应方程式为:CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH-;③因为K2Cr2O7溶液为橙色、Fe3+的溶液为黄色,颜色变化不明显,因此需要加指示剂;④根据反应方程式,建立关系式:6(NH4)2Fe(SO4)2~Cr2O72-~2CrO2-~2FeO42-,n(K2FeO4)=n[(NH4)2Fe(SO4)2]/3=30×10-3×0.1/3mol=0.001mol,K2FeO4的质量为0.001×198g=0.198g,其质量分数为0.198×4/1×100%=79.2%;(4)本题考查物料守恒等知识,A、由图中曲线可知,溶液pH=2时,不存在FeO42-,因此有c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1,故正确;B、向pH=10的溶液中加硫酸铵,溶液的pH逐渐减小,HFeO4-的分布分数逐渐增大,若加入硫酸铵较多,溶液酸性较强,则HFeO4-的分布分数先增大后逐渐减小,故错误;C、向pH=1的溶液中加HI溶液,HI具有还原性,H2FeO4有氧化性,发生氧化还原反应,故错误;D、pH=7时,HFeO4-和FeO42-共存,将K2FeO4晶体溶于水,FeO42-水解成HFeO4-,因此水溶液显碱性,故正确。


科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为v0的MOH和ROH溶液,分别加水稀释至体积v,pH随![]() 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
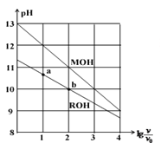
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当![]() =2时,若两溶液同时升高温度, 则c(M+)/c(R+)增大
=2时,若两溶液同时升高温度, 则c(M+)/c(R+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构简式为____________________。
(2)D中官能团的名称:__________。
(3)物质B可以被直接氧化为D,需要加入的试剂是_____________________。
(4)②的反应类型_________________________。
(5)写出①的化学方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体氧化物燃料电池(SOFC)以固体氧化物(能传导O2-)作为电解质,其工作原理如图所示。下列关于固体燃料电池的有关说法正确的是( )

A. 电极b为电池负极,电极反应式为O2+4e-=2O2-
B. 固体氧化物的作用是让电子在电池内通过
C. 若H2作为燃料气,接触面上发生的反应为:H2+2OH-—4e-=2H++H2O
D. 若C2H4作为燃料气,接触面上发生的反应为:C2H4+6O2-—12e-=2CO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中不属于氧化还原反应的是
A.烧菜用过的铁锅,经放置常出现红棕色斑迹
B.用煤气灶燃烧沼气(主要成分为甲烷:CH4)为炒菜提供热量
C.牛奶久置变质腐败
D.用醋酸除去水垢[主要成分是CaCO3、Mg (OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的叙述中,正确的是
A.金属元素的单质在常温下都是固体
B.易失电子的物质一定是金属
C.原子核外的最外层只有一个电子的元素一定是金属元素
D.铝是地壳中含量最多的金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)(1)在25℃、101kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ。则甲醇的燃烧热的热化学方程式为:_________________________________
(Ⅱ)现用中和滴定测定某盐酸溶液的浓度,有关数据记录如下:
滴定序号 | 待测液体积(mL) | 所消耗烧碱标准液的体积(mL) | ||
滴定前 | 滴定后 | 消耗的体积 | ||
1 | 25.00 | 0.50 | 25.12 | 24.62 |
2 | 25.00 | / | / | / |
3 | 25.00 | 5.00 | 29.58 | 24.58 |
(2)实验中有石蕊和酚酞两种指示剂,该实验应选用_______作指示剂。用______式滴定管盛装0.2500 mol/L烧碱标准液,锥形瓶中装有25.00mL待测盐酸溶液。
(3)下图表示第二次滴定时50 mL滴定管中前后液面的位置。该次滴定所用标准烧碱溶液体积为_______mL。

(4)根据所给数据,计算出该盐酸的物质的量浓度(注意保留合适的有效数字),c (HCl) = _____________。
(5)读数时,若滴定前仰视,滴定后俯视,则会使最终测定结果_________。(填“无影响”、“偏高”、“偏低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,前者属于电解质,后者属于非电解质的是( )
A.MgCl2晶体、食盐溶液
B.Na2O,干冰
C.熔融的KOH,液态汞
D.醋酸、氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H八种短周期主族元素在周期表中的相对位置如下图所示,已知C元素形成的单质有“国防金属”的美誉,E的最高价氧化物对应的水化物能与E的最简单氢化物反应生成离子化合物。

(1)写出B、G对应的元素符号______________ 。
(2)D元素在周期表中的位置为______________。
(3)B、E、F的简单离子半径由大到小的顺序为______________(写离子符号)。
(4)上述元素所形成的气态单质中能用于饮用水消毒的是______________(写化学式)。
(5)B的单质在F的单质中燃烧的火焰颜色为______________,所形成化合物的电子式为______________。
(6)C元素的单质可以在D和F组成的一种气态化合物中燃烧,写出该反应的化学方程式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com