
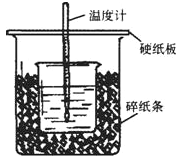
����Ŀ��(��)50mL0.5mol��L-1��������50mL0.55mol��L-1��NaOH��Һ����ͼ��ʾ��λ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ�����зų��������ɼ����к��ȡ��ش��������⣺
(1)��ʵ��װ���Ͽ�����֪��ͼװ������������֮������ָ��____________��
(2)�ڲⶨ�к��ȵ�ʵ���У����㷴Ӧ��ʱ��Ҫ��������_________
�����Ũ�Ⱥ���� �ڼ��Ũ�Ⱥ���� �۱����� �ܷ�Ӧǰ����Һ���¶Ȳ� �ݲ�������ʱ��
A.�٢ڢۢ� B. �٢ڢۢ� C. �ڢۢܢ� D. �٢ۢܢ�
(3)ʵ���и���60mL0.50mol��L-1�������50mL0.55mol��L-1��NaOH��Һ���з�Ӧ��������ʵ����ȣ������к���_________(���ȡ�����ȡ�)�����ų�������________(���ȡ�����ȡ�)��
(4)����ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ�飬��õ��к�����ֵ��______���ƫ����ƫС������Ӱ�족����
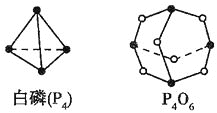
(��)��5����ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼��γɵĹ��̣���ѧ���ļ������γ�(���)1mol��ѧ��ʱ�ͷ�(������)����������֪����P4O6�ķ��ӽṹ����ͼ��ʾ�����ṩ���»�ѧ���ļ��ܣ�![]() ��
��![]() kJ��mol-1��
kJ��mol-1��![]() ��
��![]() kJ��mol-1��
kJ��mol-1��![]() ��
��![]() kJ��mol-1����ӦP4(����)+3O2=P4O6���Ȼ�ѧ��Ӧ����ʽΪ__________________��
kJ��mol-1����ӦP4(����)+3O2=P4O6���Ȼ�ѧ��Ӧ����ʽΪ__________________��
(6)��(N2H4)����Ϊ�����������ȼ�ϣ���������N2O4��Ӧ����N2��ˮ������
��֪����N2(g)+2O2(g)�TN2O4(l) ��H1�T-19.5kJmol-1
��N2H4(l)+O2(g)�TN2(g)+2H2O(g) ��H2�T-534.2kJmol-1
д���º�N2O4��Ӧ���Ȼ�ѧ����ʽ___________________ ��
(7)��ѧ��ӦN2+3H2![]() 2NH3�������仯��ͼ��ʾ���÷�Ӧ����NH3(I)���Ȼ�ѧ����ʽ��______________��
2NH3�������仯��ͼ��ʾ���÷�Ӧ����NH3(I)���Ȼ�ѧ����ʽ��______________��
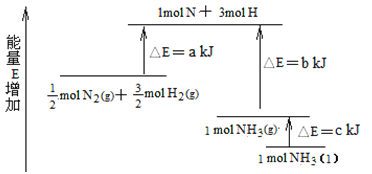
���𰸡����β�����������ڴ�С�ձ���û����������ĭ(��ֽ��)��С�ձ�������ձ��ڲ����B�������ƫСP4(���� s)+N2O4(I)=3N2(g)+2H2O(g)�� ��H=��1638kJ��mol-12N2H4(I)+N2O4(I)=3N2(g)+4H2O(g) ��H=-1048.9kJ/molN2(g)+3H2(g)![]() 2NH3(I) ��H=2(a-b-c)kJ��mol-1
2NH3(I) ��H=2(a-b-c)kJ��mol-1
��������
��1��Ϊ�˲���¶ȵ����ֵ��Ӧ����̵�ʱ������������������Ƴ�ַ�Ӧ����ȱ�ٻ��β����������Ϊ�˲���¶ȵ����ֵ��Ӧ��ǿ���¡����Ⱥͷ�ֹ����ɢʧ��ʩ��Ӧ���ڴ�С�ձ�����������ĭ����ֽ��������ʹС�ձ�������ձ�����ƽ��
(2)�ڲⶨ�к��ȵ�ʵ���У����㷴Ӧ��ʱ��Ҫ�����������Ũ�Ⱥ���������Ũ�Ⱥ�����������ݡ���Ӧǰ����Һ���¶Ȳ��ʵ���������ʱ���أ���ѡ��B�������⣻
(3)��Ӧ�ų����������������Լ�������Ķ����йأ�������60mL0.50molL-1������50mL0.55molL-1NaOH��Һ���з�Ӧ��������ʵ����ȣ�����ˮ�������࣬���ų�������ƫ�ߣ������к��ȵľ���ǿ���ǿ�Ӧ����1molˮʱ�ų����ȣ������������أ��к�����ֵ��ȣ�
(4)��ˮΪ����������Ϊ���ȹ��̣������ð�ˮ����ϡ����������Һ��Ӧ����Ӧ�ų�������С��57.3kJ��
(5)����ȼ�շų�������=������ļ���-��Ӧ��ļ���=12��360 kJ-��6��198��kJ-��3��498��kJ=1638 kJ����Ӧ���ʱ���-1638 KJ/mol����ӦP4�����ף�ȼ������P4O6���Ȼ�ѧ����ʽΪ��P4��s��+3O2��g��=P4O6��g����H=-1638 KJ/mol��
��6��N2��g��+2O2��g��=N2O4��l����H1=-19.5kJmol-1
��N2H4��l��+O2 ��g��=N2��g��+2H2O��g����H2=-534.2kJmol-1
���ݸ�˹����д���º�N2O4��Ӧ���Ȼ�ѧ���̣��ڡ�2-�ٵõ���2N2H4��l��++N2O4��l��=3N2��g��+4H2O��g����H=-1048.9 kJ/mol��
��7����ͼ��֪������1mol NH3��g���ų�������Ϊb-akJ���������ΪҺ�壬�ų�����ΪckJ����N2��g��+3H2��g��=2NH3��1����H=-2��b-a��kJ/mol+2��-c��kJ/mol=2��a-b-c��kJmol-1��


 �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��ʯ��ʯΪԭ��ͨ��ϵ�з�Ӧ����Ԫ����CaSO4����ʽ�̶����Ӷ�����SO2���ŷš���ط�Ӧ���Ȼ�ѧ����ʽ���£�CaSO4 (s)+CO (g) ![]() CaO(s)+SO2 (g)+CO2 (g) ��H1= +218.4kJ��mol��1(��Ӧ��)��CaSO4 (s) +4CO (g)
CaO(s)+SO2 (g)+CO2 (g) ��H1= +218.4kJ��mol��1(��Ӧ��)��CaSO4 (s) +4CO (g) ![]() CaS(s) +4CO2(g)��H2=��175.6kJ��mol��1 (��Ӧ��)����Ϸ�Ӧ��д��CaSO4 (s)��CaS (s) ��Ӧ���Ȼ�ѧ��Ӧ����ʽ_______��
CaS(s) +4CO2(g)��H2=��175.6kJ��mol��1 (��Ӧ��)����Ϸ�Ӧ��д��CaSO4 (s)��CaS (s) ��Ӧ���Ȼ�ѧ��Ӧ����ʽ_______��
(2)NO2��SO2�����ϴ������������ת��ƽ�⣺NO2(g)+SO2(g)![]() SO3(g)+NO(g)��ij�С��Դ˷�Ӧ�����о�ʵ��
SO3(g)+NO(g)��ij�С��Դ˷�Ӧ�����о�ʵ��
ʵ������ | ʵ������ | ���� | |
�� | ������NO2��SO2������ܱ���ƿ������ˮ�� | �������ɫ���һ��ʱ�����ɫ���ٱ仯 | ��H___0 (�������) |
�� | ����Ͳ�г���5mL NO2��5mL SO2���壬�����Ͳǰ�ˣ���ַ�Ӧ������Ѹ������5mL�� | �������ɫ������ֲ��� | ƽ��____(���������һ�)�ƶ� |
�� | �ڳ���NO2��SO2�������ĺ��������У���ƽ������ͨ��SO2���� | _____ | ƽ�������ƶ���SO2��ת����____(������С��) |
(3)��ҵ���û���̿��ԭ������NO���йط�ӦΪ��C(s) +2NO(g)![]() N2(g) +CO2(g)��Ϊ�����NO��ת���ʣ����еĴ�ʩ���е���___��
N2(g) +CO2(g)��Ϊ�����NO��ת���ʣ����еĴ�ʩ���е���___��
A���ټ���һ������̼ B������ѹǿ C���ü�Һ�������� D��ʹ�ô���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(Anammox)��һ�����͵İ���ȥ��������ԭ����ͼ��ʾ������˵����ȷ���ǣ� ��

A.1molNH4+�����ĵ���������1mol-OH�����ĵ���������ͬ
B.����II��III��IV��Ϊ��ԭ��Ӧ
C.�ø÷���ÿ����1molNH4+��Ҫ��NO2-Ϊ0.5mol
D.1mol����(N2H4)�к���5mol���ۼ�����Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г�������֮���һЩ��Ӧ��ϵ�����в��ֲ���δд����������X�ǹ��壬B��G��Һ�壬�����Ϊ���塣������ͼ��ϵ�ƶϣ�

(1)д����ѧʽ��X_______��A________��B_______��
(2)ʵ�����ռ�����D��F�ķ���������_______����________����
(3)д��C��E�Ļ�ѧ����ʽ��____________��
(4)��д��A��E��Ӧ����D�Ļ�ѧ����ʽ��_______________
(5)��������A�ķ�����������________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣�ѡ������8��Ԫ�ء�����8��Ԫ����ص���ѧ�����ش��������⣺
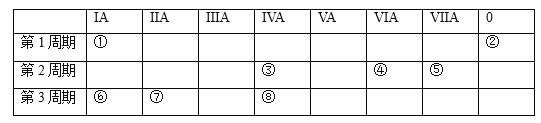
�Ż�ѧ��������õ���____________��
��Ԫ������������Ӧ��ˮ�����У�������ǿ����__________��
������÷ǽ������ʵ���_________��
�ȹ㷺Ӧ���ڵ�����Ϣ�������______��
��д��һ���⻯����������֮�䷴Ӧ�Ļ�ѧ����ʽ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019 �� 5 �£����������ѧ�����з�����������Ч��֯��[����S/ HPCNF (�ּ����̼������ά)]﮿������ε�أ��� S/ HPCNF ֯���Ͼ��ȵس���ͭ������ȡ��һ��﮵�ر���Ľ������� ����������ȣ���صĹ���ԭ����ͼ�������й�˵���������

A.�ŵ�ʱ��O2������������������Ӧ
B.����ͭ������Ϊ����ǿ֯��ĵ�����
C.���ʱ��Li+��������һ��
D.���ʱ�������ĵ缫��ӦΪLi2O2��2e-��O2����2Li+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȩ�� ������һ�����µĻ��㣬����ˮ��ϴ�ӻ����䷽Ҳ�dz��м�ֵ����ͼ����Michael��Ӧ�ϳɻ���ȩ��һ�ֺϳ�·�ߡ�
������һ�����µĻ��㣬����ˮ��ϴ�ӻ����䷽Ҳ�dz��м�ֵ����ͼ����Michael��Ӧ�ϳɻ���ȩ��һ�ֺϳ�·�ߡ�

��֪�����������ڱ������ױ�������
�ش��������⣺
(1)����ȩI�й����ŵ�������___����ͨ�� ֱ���ж�___��ѡ���ţ���
a������ ��b��������ס� ��c���˴Ź�������
(2)A��B�ķ�Ӧ����ʽΪ___��
(3)B��C��C��D�ķ�Ӧ���ͷֱ���___��___��
(4)E�Ľṹ��ʽΪ____��
(5)�Աȷ���˵��������C��D��E��F�����Ŀ����___��
(6)�л���G�ж���ͬ���칹�壬 д����������������һ��ͬ���칹��___��
�ٱ�������3��ȡ�������ں˴Ź���������4����
(7)����Michael��Ӧ�� �Ա�ϩ�� Ϊԭ�Ϻϳ�
Ϊԭ�Ϻϳ� �� д���ϳ�·�ߣ����Լ���ѡ�� ___��
�� д���ϳ�·�ߣ����Լ���ѡ�� ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ˮ�д��ڶ��ַ��Ӻ����ӣ�����ʵ������ͽ���һ������ȷ����(����)
A. ������ˮʹ��õ���Ϊ��õ�壬˵����Cl2
B. ����ʯ����Һ����Һ��죬˵������Һһ������HClO
C. ��KHCO3����������Ƶ���ˮ�У������ݲ�����˵����HClO
D. ����������ˮ�������ݳ���������һ����O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�������ܱ������н��з�Ӧ��2SO2(g)��O2(g)![]() 2SO3(g)����H<0�����и�ͼ��ʾ��������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ����
2SO3(g)����H<0�����и�ͼ��ʾ��������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ����
A. ͼ ��ʾ�¶ȶ�ƽ���Ӱ�죬�Ҽ��¶Ƚϸ�
��ʾ�¶ȶ�ƽ���Ӱ�죬�Ҽ��¶Ƚϸ�
B. ͼ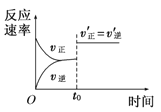 ��ʾt0ʱ�̺��ݳ���He(g)
��ʾt0ʱ�̺��ݳ���He(g)
C. ͼ ��ʾt0ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
��ʾt0ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
D. ͼ ��a��v�� > v��
��a��v�� > v��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com