
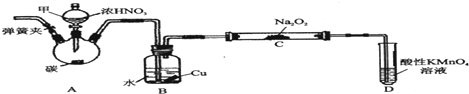

分析 (1)根据装置图可知甲仪器的名称,装置A烧瓶中用碳与浓硝酸在加热的条件下反应生成二氧化碳和二氧化氮;
(2)二氧化氮遇水生成NO和硝酸,得到的稀硝酸与铜反应又生成NO,据此答题;
(3)为防止产生碳酸钠和氢氧化钠,应除去NO中的水份和二氧化碳气体;
(4)装置D中未反应的NO被高锰酸钾氧化成硝酸,根据电荷守恒写离子方程式;
(5)根据2NO+Na202=2NaN02,可知溶液A含有NO2-,高锰酸钾具有氧化性,能将NO2-氧化为NO3-,反应的实质是:2MnO4-+5NO2-+6H+=2Mn2++3H2O+5NO3-;
(6)根据5(NH4)2 Fe(S04)2~MnO4-,消耗n(KMn04)=0.1mol/L×0.01L=0.001mol,
根据 2MnO4-~5NO2-,计算样品中NaN02的纯度;
(7)A.滴定至溶液紫色刚刚好褪去,消耗的(NH4)2 Fe(S04)2偏小,导致的量结果偏高;
B.加入A与KMn04溶液前锥形瓶未经干燥,对测量结果无影响;
C.实验中使用的(NH4)2Fe(S04)2溶液暴露在空气中时间过长,部分(NH4)2 Fe(S04)2被氧化,消耗的(NH4)2 Fe(S04)2偏大,导致的量结果偏低,据此答题;
解答 解:(1)根据装置图可知甲仪器的名称是分液漏斗,装置A烧瓶中,碳和浓硝酸反应生成二氧化碳、二氧化氮和水,方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
故答案为:分液漏斗;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(2)B装置中,NO2与水反应生成NO,同时铜与稀硝酸反应也生成NO,
故答案为:将NO2转化为NO,同时铜与稀硝酸反应生成NO;
(3)有同学认为装置c中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,那么NO中混有CO2、NO2,可以在B、C之间增加装有碱石灰或生石灰的装置E,以吸收杂质CO2、NO2,
故答案为:BD;
(4)装置D中未反应的NO被高锰酸钾氧化成硝酸,反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,
故答案为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O;
(5)根据2NO+Na202=2NaN02,可知溶液A含有NO2-,高锰酸钾具有氧化性,能将NO2-氧化为NO3-,反应的实质是:2MnO4-+5NO2-+6H+=2Mn2++3H2O+5NO3-,故答案为:2MnO4-+5NO2-+6H+=2Mn2++3H2O+5NO3-;
(6)根据5(NH4)2 Fe(S04)2~MnO4-,消耗n(KMn04)=0.1mol/L×0.01L=0.001mol,
2MnO4-~5NO2-,
2 5
0.05mol/L×0.024L-0.001mol x,
x=0.0005mol,100mL中n(NaN02)=0.0005mol×$\frac{100mL}{10mL}$=0.005mol,
则样品中NaN02的纯度为$\frac{0.005mol×69g/mol}{2.3g}$×100%=75%,
故答案为:75%;
(7)A.滴定至溶液紫色刚刚好褪去,消耗的(NH4)2 Fe(S04)2偏小,导致的量结果偏高,故A错误;
B.加入A与KMn04溶液前锥形瓶未经干燥,对测量结果无影响,故B错误;
C.实验中使用的(NH4)2Fe(S04)2溶液暴露在空气中时间过长,部分(NH4)2 Fe(S04)2被氧化,消耗的(NH4)2 Fe(S04)2偏大,导致的量结果偏低,故C正确;
故答案为:C.
点评 本题是一道实验方案的设计和探究题,考查学生分析和解决问题的能力,综合性强,难度大.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有10NA个电子转移时,放出1300kJ的能量 | |
| B. | 有44.8LCO2气体生成时,放出1300kJ的能量 | |
| C. | 有NA个水分子生成且为液体时,吸收1300kJ的能量 | |
| D. | 有4NA个碳氧共用电子对生成时,放出1300kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8mol | B. | 4mol | C. | 2mol | D. | 6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 2NH3.
2NH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强(kPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-) | |
| B. | c(Na+)=2c(S2-)+c(OH-)+c(HS-) | |
| C. | c(Na+)=c(S2-)+c(HS-) | |
| D. | 向溶液中加入少量NaOH固体,能促进水的电离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com