
| 催化剂 |
| △ |
| 催化剂 |
| △ |


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
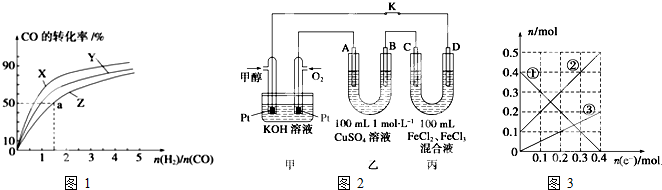
查看答案和解析>>
科目:高中化学 来源: 题型:
 认真读书,回归课本,请回答下列问题:
认真读书,回归课本,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4mol、2mol、0mol、2mol |
| B、2mol、1mol、2mol、2mol |
| C、2mol、1mol、2mol、1mol |
| D、2mol、1mol、0mol、1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2CH2OH |
B、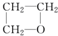 |
| C、CH3CH2OCH3 |
| D、CH3CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:
 粗镍经过下列过程可以转化为纯度99.9%的高纯镍,管状反应装置如图.
粗镍经过下列过程可以转化为纯度99.9%的高纯镍,管状反应装置如图.| 50℃-180℃ |
| 180℃-200℃ |
| A、反应管粗镍端为低温区,高纯镍端为高温区 |
| B、该反应体系在一定条件下达到平衡状态的标志之一是体系的压强不变 |
| C、提纯过程中,CO会逐渐减少 |
| D、该装置可用于碘的提纯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com