
一定温度下的恒容密闭容器中,反应A2(g)+B2(g)  2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A.容器内n(A2): n(B2):n(AB)="1:1:2"
B.容器内气体的密度不随时间变化
C.容器内气体的总压强不随时间变化
D.单位时间内生成2n mol AB,同时生成n mol A2
D
解析试题分析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,A不能说明;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,B不能说明;该反应是体积不变的可逆反应,所以容器内气体的压强始终是不变的,C不能说明;D中反应速率的方向相反,且满足反应速率之比是相应的化学计量数之比,可以说明反应达到平衡状态,答案选D。
考点:考查可逆反应平衡状态的判断
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。


科目:高中化学 来源: 题型:单选题
下列有关化学反应速率的说法中,正确的是 ( )
| A.100 mL 2 mol/L盐酸与锌反应时,加入100 mL氯化钠溶液,生成氢气的速率不变 |
B.对于可逆反应2CO + 2NO  N2 + 2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 N2 + 2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 |
| C.二氧化硫的催化氧化是一个放热反应,升高温度,正反应速率减慢 |
| D.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快氢气的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某反应中,X、Y、Z三种物质的物质的量随时间的变化如图所示。下列说法正确的是
| A.反应为 X + 2Z= Y |
B.反应为 X + Y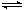 2Z 2Z |
| C.4 s 时,反应达到平衡 |
| D.12 s 时,反应不再进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
其他条件不变的情况下,下列说法不正确的是( )
A.对于反应nA(g)+B(g) 2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
B.对于反应2A(g) B(g)△H<0,恒温恒容,压强不再变化说明反应达到平衡状态。
B(g)△H<0,恒温恒容,压强不再变化说明反应达到平衡状态。
C.对于反应2A(g) B(g),恒温恒容条件下,气体密度不变,说明达到平衡状态
B(g),恒温恒容条件下,气体密度不变,说明达到平衡状态
D.对于反应2A(g) B(g),若v(A)正=2v(B)逆,说明反应达到平衡状态
B(g),若v(A)正=2v(B)逆,说明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下,将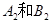 两种气体通入密闭容器中,反应按
两种气体通入密闭容器中,反应按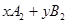

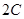 进行,2秒钟后反应速率如下:
进行,2秒钟后反应速率如下: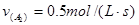 ,
,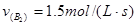 ,
,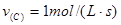 ,则x、y的值分别为( )
,则x、y的值分别为( )
| A.3和2 | B.1和3 | C.3和1 | D.4和5 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一固定体积的密闭容器中加入2 mol A和1 mol B发生反应2A(g)+B(g) 3C(g)+D(g),达到平衡时C的浓度为w mol·L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol·L-1的配比是( )
3C(g)+D(g),达到平衡时C的浓度为w mol·L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol·L-1的配比是( )
| A.4 mol A+2 mol B | B.3 mol C+1 mol D+2mol A+1 mol B |
| C.3mol C+1 mol D+1 mol B | D.3 mol C+1 mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某可逆反应L(s) + G(g)  3R(g) △H>0,下图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
3R(g) △H>0,下图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )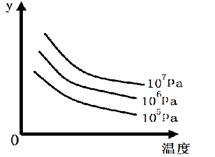
| A.平衡混合气中R的质量分数 | B.达到平衡时G的转化率 |
| C.平衡混合气中G的质量分数 | D.达到平衡时L的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)(1)氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g)
CO2(g) + 3H2(g) 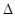 H(298K)=+ 49.4 kJ/mol
H(298K)=+ 49.4 kJ/mol
一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的 倍。
②该条件下的该反应的平衡常数是 (结果保留两位有效数字)。
③该条件下反应达平衡状态的依据是(填序号) 。
| A.v正(CH3OH)=v正(CO2) | B.混合气体的密度不变 |
| C.c(CH3OH)=c(H2O) | D.混合气体的总物质的量不变 |
 2SO3(g)
2SO3(g) 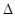 H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b _______ 1(填“﹤”、“﹥”或“=”) 。
H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b _______ 1(填“﹤”、“﹥”或“=”) 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
2NH3(g) 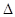 H="-92.4" kJ/mol,该反应的能量变化如图所示。
H="-92.4" kJ/mol,该反应的能量变化如图所示。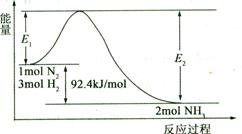
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的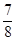 ,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
| A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
 4NH3(g)+3O2(g)
4NH3(g)+3O2(g) 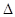 H="+1530" kJ/mol
H="+1530" kJ/mol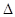 H="+44.0" kJ/mol
H="+44.0" kJ/mol 4NH3(g)+3O2(g)
4NH3(g)+3O2(g) 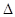 H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com