
 ;
;分析 (1)碳与短周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q是O2、R是CO2,在二氧化碳分子中每个O原子和C原子之间能形成两对共用电子对;
(2)将不溶性固体和液体分离通常采用的方法是过滤;Na可以与水(或乙醇)发生反应,金刚石不可以;
(3)Si与氢氧化钠溶液反应生成硅酸钠与氢气;根据n=cV计算Na2SiO3的物质的量,硅酸钠原与Si、二氧化硅与氢氧化钠反应得到,根据Si元素守恒计算二氧化硅物质的量,根据m=nM计算Si、二氧化硅的质量,进而计算SiC的质量,可以计算SiC的纯度;
(4)①Na还原CCl4的反应属于置换反应,但Cl2与H2O反应生成HCl和HClO;
②元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
③钠、锂分别在空气中燃烧,生成的氧化物分别为Na2O2、Li2O.
④二氧化硅属于原子晶体,而干冰属于分子晶体.
解答 解:(1)碳元素在周期表中的位置是:第二周期第ⅣA族,由题给信息“碳与Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子”可推知Q为氧,非极性分子R为CO2,CO2的电子式为 ,
,
故答案为:第二周期第ⅣA族;O; ;
;
(2)金刚石是不溶于CCl4的固体,CCl4是液体,将不溶性固体和液体分离通常采用的方法是过滤;由于Na可以与水(或乙醇)发生反应,而金刚石不与水(或乙醇)反应,所以除去粗产品中少量的钠可用水(或乙醇),
故答案为:过滤;水(或乙醇);
(3)硅与NaOH反应的化学方程式Si+2NaOH+H2O═Na2SiO3+2H2↑,其离子方程式为:Si+2OH-+H2O═SiO32-+2H2↑,反应生成0.1mol氢气,则生成硅酸钠为0.1mol×$\frac{1}{2}$=0.05mol,溶液中硅酸盐的物质的量为0.17mol•L-1×1L=0.17mol,硅酸钠原与Si、二氧化硅与氢氧化钠反应得到,根据Si元素守恒,二氧化硅物质的量为0.17mol-0.05mol=0.12mol,则产品中Si与SiO2的总质量=0.05mol×28g/mol+0.12mol×60g/mol=8.6g,故SiC的质量为20.0g-8.6g=11.4g,则SiC的纯度为$\frac{11.4g}{20g}$×100%=57%,
故答案为:Si+2OH-+H2O═SiO32-+2H2↑;57%;
(4)①Na还原CCl4的反应属于置换反应,但Cl2与H2O反应生成HCl和HClO,不是置换反应,故①错误;
②Na2SiO3溶液与SO3的反应,说明酸性H2SiO3比H2SO4弱,则可用于推断Si与S的非金属性强弱,故②正确;
③钠、锂分别在空气中燃烧,生成的氧化物分别为Na2O2、Li2O,阴阳离子数目比均为1:2,故③正确;
④二氧化硅属于原子晶体,而干冰属于分子晶体,熔化时克服粒子间作用力的类型不相同,故④错误.
故选:②③,
故答案为:②③.
点评 本题综合元素化合物知识,注意从质量守恒的角度结合反应的化学方程式计算,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| B. | 喝补铁剂时,加服维生素C,效果更好,原因是维生素C具有氧化性 | |
| C. | 食用花生油和鸡蛋清都能发生水解反应 | |
| D. | “地沟油”经加工处理后,可用于生产肥皂和生物柴油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
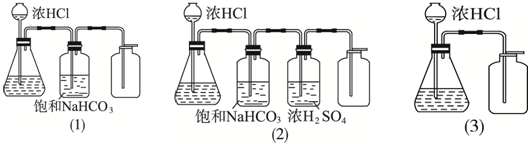
| A. | (1)(2)(3)一样重 | B. | (1)中最重 | C. | (2)中最重 | D. | (3)最轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
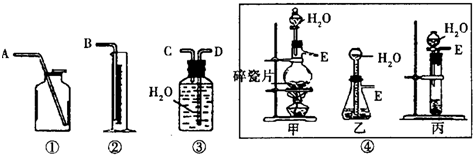
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
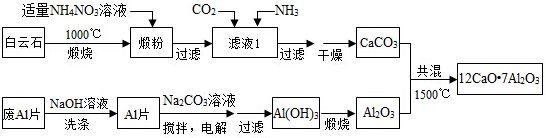
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸遇明火发热爆炸 | |
| B. | 浓硫酸遇水发热爆炸 | |
| C. | 铁与水反应产生氢气,氢气接触空气后遇明火爆炸 | |
| D. | 稀释后的硫酸与铁反应产生氢气接触明火爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
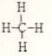 ;X、Z、N形成的原子个数比1:1:1的分子的电子式
;X、Z、N形成的原子个数比1:1:1的分子的电子式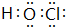 .
.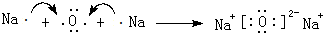 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com